
BAB I
PENDAHULUAN
1.1 Latar Belakang
Protein adalah makromolekul yang terdapat di semua sel hidup. Beberapa protein merupakan komponen struktural yang menyusun kulit, kuku, tulang rawan, dan otot. Protein lain berperan dalam mengkatalisis reaksi metabolisme, transpor oksigen, hadir dalam bentuk hormon untuk regulasi proses dalam tubuh dan berbagai peran lainnya. Apapun fungsinya, semua protein secara kimiawi adalah sama yakni tersusun atas molekul-molekul yang lebih kecil disebut asam amino (Brown et al., 2012). Asam-asam amino yang terdapat dalam protein adalah berupa asam α-amino karboksilat. Asam amino mengandung gugus amino (-NH2) dan karboksilat (-COOH) (Wardiyah, 2016). Tiap asam amino pada protein memiliki bentuk yang berbeda satu sama lain. Dua puluh jenis asam amino pada protein dalam tubuh manusia memiliki kuantitas dan kombinasi yang bervariasi (Tellingen, 2001). Perbedaan tersebut terletak pada perbedaan rantai samping dengan sifat-sifat fisik dan kimia rantai tertentu. Asam amino yang bersifat asam memiliki rantai samping yang umumnya bermuatan negatif, akibat keberadaan gugus karboksil, sedangkan amino yang bersifat basa memiliki gugus amino pada rantai sampingnya yang umumnya bermuatan positif (Campbell et al., 2010). Dengan demikian, sifat fisika dan kimiawi (struktur dan fungsi) protein ditentukan oleh kombinasi, jumlah, dan urutan asam amino penyusunnya (Wardiyah, 2016). Berdasarkan perbedaan sifat tersebut, maka dilakukan uji kualitatif pada beberapa jenis asam amino dan protein untuk mengetahui sifat dari sampel uji berdasarkan reaksi yang ditunjukkan.
1.2 Maksud dan Tujuan Percobaan
1.2.1 Maksud Percobaan
Maksud dari percobaan ini adalah untuk mengenal beberapa sifat asam amino dan protein berdasarkan reaksi pewarnaan.
1.2.2 Tujuan Percobaan
Tujuan dari percobaan adalah sebagai berikut:
- mengidentifikasi asam amino dan protein berdasarkan uji millon.
- mengidentifikasi asam amino dan protein berdasarkan uji ninhidrin.
- mengidentifikasi asam amino dan protein berdasarkan uji biuret.
1.3 Prinsip Percobaan
Prinsip dari percobaan ini adalah mengidentifikasi adanya gugus α-amino bebas pada asam amino dan protein dengan penambahan ninhidrin dan pemanasan, mengidentifikasi adanya ikatan peptida dengan penambahan NaOH dan CuSO4 serta mengidentifikasi adanya gugus hidroksifenil pada asam amino dan protein dengan penambahan pereaksi millon dan pemanasan.
BAB II
TINJAUAN PUSTAKA
2.1 Karbohidrat
Protein merupakan molekul organik besar yang terdiri dari rantai asam amino. Kata protein, berasal dari bahasa Yunani proteios, berarti memegang tempat pertama. Hal tersebut dikarenakan protein memegang peran terpenting bagi organisme yakni mengontrol berbagai proses biologis termasuk metabolisme, pertumbuhan sel dan neurotransmisi (Walker dan McMahon, 2008), baik pada organisme tingkat rendah sampai dengan organisme tingkat tinggi (Katili, 2009). Jaringan protein internal, sitoskeleton, mempertahankan bentuk seluler dan integritas fisik. Filamen aktin dan miosin membentuk mesin kontraktil otot. Hemoglobin mengangkut oksigen, sementara antibodi bersirkulasi mencari antigen tanpa henti. Enzim mengkatalisis reaksi yang menghasilkan energi, mensintesis dan mendegradasi biomolekul, mereplikasi dan menyalin gen, memproses mRNA dan lain sebagainya. Reseptor memungkinkan sel untuk merasakan dan merespons hormon serta rangsangan lingkungan lainnya. Seluruh struktur tersebut tersusun atas protein struktural maupun fungsional (Murray et al., 2009).
Manusia memiliki puluhan ribu protein yang berbeda, masing-masing dengan struktur dan fungsi yang spesifik. Meskipun protein beraneka ragam, semuanya merupakan polimer yang tersusun dari suatu set yang sama, yakni terdiri dari 20 asam amino. Polimer asam amino disebut polipeptida. Protein terdiri dari satu atau lebih polipeptida yang masing-masing terlipat dan mengumpar menjadi struktur berdimensi tiga yang unik dan spesifik (Campbell et al., 2010).
Berdasarkan strukturnya, protein terbagi atas 4 jenis yakni (Siddiqui, 2017):
- Struktur primer: sekuens linear asam amino yang disatukan oleh ikatan peptida.
- Struktur sekunder: struktur primer protein yang terlipat membentuk struktur sekunder.
- Struktur tersier: terdiri atas 2 atau lebih struktur sekunder protein.
- Struktur kuartener: beberapa ikatan peptida membentuk struktur kuartener yang kompleks.
2.2 Asam Amino
Asam amino merupakan molekul organik yang memiliki gugus fungsional karboksil (-COOH) dan gugus amina (NH2). Semua asam amino memiliki kesamaan struktur yaitu bagian tengah struktur terdapat atom karbon (Cα) yang bersifat asimetrik. Atom karbon tersebut berikatan dengan gugus amina, gugus karboksil, atom hidrogen dan gugus R (residue) yang juga disebut sebagai rantai samping. Rantai samping berbeda-beda untuk setiap jenis asam amino (Campbell et al., 2010). Dua puluh jenis rantai samping tersebut bervariasi yakni dari segi ukuran, bentuk struktur, muatan, kapasitas ikatan hidrogen, karakter hidrofobik (reaksi terhadap air) dan reaktivitas kimia (Berg et al., 2002).
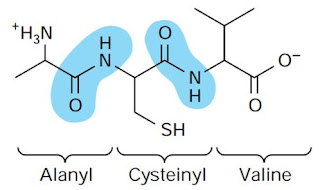
Asam amino berikatan satu sama lain dalam rantai polipeptida yang dihubungkan oleh suatu ikatan peptida yang terbentuk di antara dua gugus fungsional. Satu rantai polipeptida dapat mengandung 10 hingga 49 unit asam amino. Namun, ketika rantai polipeptida bergabung dengan rantai polipeptida lainnya, akan membentuk 50 hingga 3.000 asam amino (Siddiqui, 2017). Ikatan peptida pada protein merupakan kelompok jenis reaktif, yaitu substrat dari sejumlah besar protease (Improta et al., 2011).
Gambar 1. Ikatan peptida (Murray dkk., 2009)
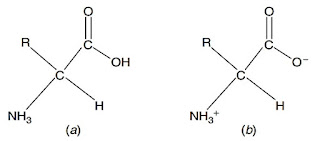
Asam amino dapat berupa zwitter ion. Zwitter ion merupakan substansi yang mengandung jumlah muatan positif dan negatif yang sama. Hal tersebut disebabkan, karena adanya gugus karboksil dan amina yang dapat bermuatan positif maupun negatif (Mathews et al., 2000). Gugus amina membawa muatan positif (NH3+) dan gugus karboksil membawa muatan negatif (CO2-). Dua muatan tersebut menyebabkan molekul asam amino dapat bersifat asam maupun basa, disebut sebagai amfoter (amphoteric) (Walker dan McMahon, 2008).
Gambar 2. (a) asam amino netral, dan (b) asam amino dalam bentuk zwitter ion (Walker dan McMahon, 2008)
Sebagai pembangun protein, memiliki semua jenis asam amino dalam tubuh sangatlah penting. Defisiensi asam amino akan memberikan dampak yang sangat fatal bagi tubuh. Contohnya adalah apabila defisiensi asam amino terjadi pada otot, maka otot akan mengalami degradasi walaupun kebutuhan kalori dan nutrisi lainnya terpenuhi (Walker dan McMahon, 2008). Berdasarkan fungsi biologisnya, asam amino diklasifikasikan menjadi dua, yakni asam amino esensial dan asam amino non esensial (Wardiyah, 2016).
2.2.1 Asam Amino Esensial
Asam amino esensial adalah golongan asam amino yang tidak dapat disintesa oleh tubuh sehingga memerlukan tambahan asam amino esensial yang diperoleh dari bahan pangan atau pakan yang dikonsumsi (Elfita, 2014). Menurut Selcuk et al., dalam Purwaningsih et al. (2013), asam amino esensial untuk orang dewasa terdiri dari lisin, leusin, isoleusin, treonin, metionin, valin, fenilalanin dan triptofan, sedangkan asam amino esensial bagi anak-anak ditambah arginin dan histidin. Protein yang bermutu tinggi adalah protein yang mengandung semua jenis asam amino esensial dalam proporsi yang sesuai untuk pertumbuhan.
2.2.2 Asam Amino Non Esensial
Asam amino non esensial adalah asam amino yang dapat disediakan oleh tubuh organisme. Produksi asam amino non esensial terjadi melalui proses biosintesa yang rumit dari senyawa nitrogen yang terdapat dalam makanan (Elfita, 2014). Asam amino non-esensial terdiri dari asam aspartat, asam glutamat, alanin, asparigin, sistein, glisin, prolin, tirosin, serin dan glutamin (Selcuk et al., dalam Purwaningsih et al., 2013).
2.3 Reaksi Uji terhadap Asam Amino
Telah diketahui bahwa tidak semua protein memiliki kandungan asam amino yang sama. Adanya variasi konstituen asam amino pada protein dapat diidentifikasi melalui reaksi-reaksi pewarnaan. Berdasarkan sifat fisik dan kimia serta kehadiran asam amino yang berbeda, protein dapat dianalisa melalui reaksi yang dihasilkan dalam uji pewarnaan protein. Uji pewarnaan protein merupakan jenis metode analisis protein secara kualitatif di samping reaksi presipitasi. Uji protein berdasarkan warna yang umum digunakan di antaranya adalah uji millon, uji ninhidrin dan uji biuret (Siddiqui, 2017).
2.3.1 Uji Millon
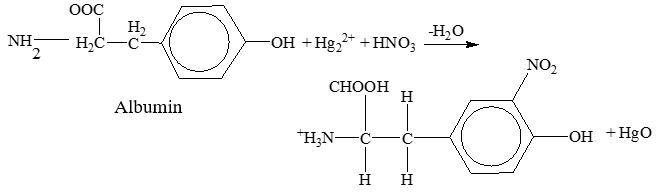
Uji millon disebut juga reaksi hoffman. Reaksi ini bekerja terhadap gugus hidroksil fenol. Asam amino tirosin atau protein yang mengandung tirosin akan membentuk kompleks berwarna merah bersama dengan reagen millon. Timbulnya warna ini diduga akibat pembentukan ion fenolat merkuri dengan fenol bebas yang ternitrasi dalam tirosin (Siddiqui, 2017).
2.3.2 Reaksi Uji terhadap Asam Amino
Ninhidrin merupakan agen pengoksidasi yang kuat dan bereaksi dengan gugus α-amino dari asam amino atau protein. Ninhidrin akan tereduksi menjadi hidridantin ketika bereaksi dengan asam α-amino sementara amino berubah menjadi aldehida, amonia, dan karbon dioksida. Hidridantin akan bereaksi dengan amonia bebas dan molekul lain dari ninhidrin untuk membentuk kompleks warna ungu. Oleh karena itu, ninhidrin dapat digunakan dalam mengidentifikasi adanya asam amino (Siddiqui, 2017).
2.3.3 Uji Biuret
Reagen biuret mengandung senyawa tembaga sulfat (CuSO4). Biuret dibentuk dengan pemanasan urea dan mempunyai struktur mirip dengan struktur pepetida dari protein. Prinsip reaksi Biuret adalah reaksi antara tembaga sulfat dalam alkali dengan senyawa yang berisi dua atau lebih ikatan peptida seperti protein yang memberikan warna ungu biru yang khas. Fungsi reagen Biuret adalah untuk membentuk kompleks sehingga yang dikandung dapat diidentifikasi. Reaksi Biuret ini bersifat spesifik, artinya hanya senyawa yang mengandung ikatan peptida saja yang akan bereaksi dengan pereaksi Biuret (Bintang, dalam Machin 2012).
BAB III
METODOLOGI PERCOBAAN
3.1 Bahan Percobaan
Bahan yang digunakan dalam percobaan ini adalah asam amino glisin, sistein, sistin, metionin, alanin, tirosin, arginin, asparagin, gelatin, albumin, pereaksi millon, larutan ninhidrin 0,1 %, NaOH 2 N, CuSO4 0,01 N, akuades, dan tisu.
3.2 Alat Percobaan
Alat yang digunakan dalam percobaan ini adalah tabung reaksi, rak tabung, pipet tetes, penjepit tabung, bunsen, korek api, dan sikat tabung.
3.3 Prosedur Percobaan
3.3.1 Uji Millon
Disiapkan 10 buah tabung reaksi yang bersih dan kering. Masing-masing tabung reaksi diisi dengan 2 mL glisin, sistein, sistin, metionin, alanin, tirosin, arginin, asparagin, gelatin, dan protein (albumin). Ditambahkan 5 tetes pereaksi millon. Dikocok kemudian dipanaskan sambil digoyang-goyangkan dan diamati reaksinya. Dicatat perubahan yang terjadi.
3.3.2 Uji Ninhidrin
Disiapkan 10 buah tabung reaksi yang bersih dan kering. Masing-masing tabung reaksi diisi dengan 2 mL glisin, sistein, sistin, metionin, alanin, tirosin, arginin, asparagin, gelatin, dan protein (albumin). Ditambahkan 0,5 mL larutan ninhidrin 0,1 % dan dikocok. Dipanaskan sampai mendidih, kemudian diamati dan dicatat perubahan yang terjadi.
3.3.3 Uji Biuret
Disiapkan 10 buah tabung reaksi yang bersih dan kering. Masing-masing tabung reaksi diisi dengan 2 mL glisin, sistein, sistin, metionin, alanin, tirosin, arginin, asparagin, gelatin, dan protein (albumin). Ditambahkan 1 mL NaOH 2 N, dikocok kemudian ditambahkan setetes CuSO4 0,01 N. Dikocok dan diamati perubahan yang terjadi. Jika tidak timbul warna ditambahkan setetes atau lebih CuSO4.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan Uji Millon
4.1.1 Data Hasil Pengamatan
Tabel 1. Data hasil pengamatan uji Millon
|
No.
|
Larutan contoh
|
Perubahan setelah
ditambah pereaksi Millon
|
Perubahan
setelah dipanaskan
|
|
1.
|
L-Glisin
|
Bening (tidak terjadi perubahan warna)
|
Tidak terjadi perubahan warna
|
|
2.
|
L-Sistin
|
Putih keruh
|
Putih keruh, ada endapan
|
|
3.
|
L-Sistein
|
Putih keruh
|
Abu-abu charcoal, ada endapan
|
|
4.
|
L-Alanin
|
Bening (tidak terjadi perubahan warna)
|
Tidak terjadi perubahan warna
|
|
5.
|
L-Arginin
|
Bening (tidak terjadi perubahan warna)
|
Tidak terjadi perubahan warna
|
|
6.
|
L-Metionin
|
Bening (tidak terjadi perubahan warna)
|
Tidak terjadi perubahan warna
|
|
7.
|
L-Tirosin
|
Agak keruh (tidak terjadi perubahan
warna)
|
Merah pekat
|
|
8.
|
L-Asparagin
|
Bening (tidak terjadi perubahan warna)
|
Tidak terjadi perubahan warna
|
|
9.
|
Gelatin
|
Agak keruh (tidak terjadi perubahan warna)
|
Tidak terjadi perubahan warna
|
|
10.
|
Albumin
|
Agak keruh (tidak terjadi perubahan
warna)
|
Agak kemerahan, menggumpal
|
4.1.2 Reaksi
1. Glisin
2. Sistin
3. Sistein
4. Alanin
5. Arginin
6. Metionin
7. Tirosin
8. Asparagin
9. Gelatin
10. Albumin
4.1.3 Pembahasan
Reagen Millon digunakan untuk mengidentifikasi adanya protein dalam suatu sampel. Reagen ini akan bereaksi dengan residu asam amino yang mengandung gugus hidroksifenol, yakni tirosin. Reaksi ini ditunjukkan pada Tabel 1. di mana larutan tirosin yang ditetesi reagen Millon lalu dipanaskan memunculkan kompleks berwarna merah. Hasil serupa ditunjukkan oleh albumin (mengandung tirosin) yang memunculkan warna agak kemerahan serta penggumpalan akibat pemanasan. Berdasarkan literatur, bersama reagen Millon yang mengandung nitrat, gugus fenol akan ternitratasi. Selanjutnya tirosin yang ternitratasi bereaksi dengan ion Hg dalam reagen dan membentuk kompleks merah. Adapun pada larutan contoh gelatin, tidak terjadi perubahan warna. Hasil ini tidak sesuai dengan teori karena dalam gelatin terdapat gugus fenol dari asam amino tirosin. Penyimpangan ini diduga disebabkan oleh kesalahan dalam pengujian seperti kurangnya jumlah pereaksi yang diberikan atau kondisi sampel gelatin yang sudah tidak baik. Dari hasil yang didapatkan, sampel sistein juga mengalami perubahan warna dari putih keruh menjadi abu-abu charcoal. Penyimpangan ini pun diduga disebabkan oleh kondisi sampel yang sudah tidak baik sehingga merusak struktur kimia sampel.
4.2 Hasil Pengamatan Uji Ninhidrin
4.2.1 Data Hasil Pengamatan
Tabel 2. Data hasil pengamatan uji Ninhidrin
No. | Larutan contoh | Perubahan setelah ditambah larutan Ninhidrin | Perubahan setelah dipanaskan |
1. | L-Glisin | Bening | Bening |
2. | L-Sistin | Bening | Keruh |
3. | L-Sistein | Putih keruh | Putih keruh, ada endapan |
4. | L-Alanin | Bening | Bening |
5. | L-Arginin | Bening | Kuning |
6. | L-Metionin | Bening | Bening |
7. | L-Tirosin | Bening | Bening |
8. | L-Asparagin | Bening | Kuning |
9. | Gelatin | Keruh | Kuning |
10. | Albumin | Keruh | Merah, ada endapan |
Tabel 3. Data hasil pengamatan uji Biuret
No. | Larutan contoh | Perubahan setelah ditambah NaOH 2 N | Perubahan setelah ditambah CuSO4 0,01 N |
1. | L-Glisin | Bening | Biru |
2. | L-Sistin | Bening | Biru keunguan |
3. | L-Sistein | Bening | Biru |
4. | L-Alanin | Bening | Biru |
5. | L-Arginin | Bening | Biru |
6. | L-Metionin | Bening | Biru |
7. | L-Tirosin | Bening | Biru |
8. | L-Asparagin | Bening | Biru |
9. | Gelatin | Bening | Ungu |
10. | Albumin | Bening | Ungu |
4.2.2 Reaksi
1. Glisin
2. Sistin

3. Sistein

4. Alanin

5. Arginin

6. Metionin

7. Tirosin

8. Asparagin

9. Gelatin

10. Albumin

4.3.3 Pembahasan
Uji biuret dilakukan untuk mengidentifikasi protein melalui reaksi dengan ikatan peptida dalam protein. Ketika reagen biuret bercampur dengan protein peptida, terjadi perpindahan hidrogen peptida diikuti pembentukan ikatan kovalen koordinasi ion Cu2+ dari reagen dengan atom nitrogen (N) dari protein. Ikatan ini memunculkan kompleks chelate yang tampak berwarna ungu. Semakin panjang ikatan peptida dari suatu sampel, semakin pekat pula warna kompleks yang tampak. Hasil reaksi yang dilakukan menunjukkan uji positif pada sampel gelatin dan albumin, mengindikasikan kehadiran ikatan peptida.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan dari percobaan yang telah dilakukan adalah sebagai berikut:
- pada reaksi millon, uji positif ditunjukkan oleh tirosin dan protein (albumin) yang mengindikasikan keberadaan gugus hidroksifenol.
- pada reaksi ninhidrin terjadi penyimpangan teori di mana seluruh sampel menunjukkan hasil negatif.
- pada reaksi biuret, sampel gelatin dan protein (albumin) menunjukkan hasil positif mengindikasikan adanya ikatan peptida.
5.2 Saran
5.2.1 Saran untuk Praktikum
Sebaiknya metode analisa kualitatif protein dan asam amino dapat lebih divariasikan.
5.2.2 Saran untuk Laboratorium
Sebaiknya diadakan pengecekan fasilitas laboratorium disertai perbaikan fasilitas yang rusak, contohnya westafel yang bocor dan menyebabkan air tumpah dan tergenang.
DAFTAR PUSTAKA
Berg, J.M., Tymoczko, J.L., dan Stryer,
L., 2002, Biochemistry, 5th
Edition, W.H. Freeman, New York.
Brown, T.L., Lemay, H.E., Bursten,
B.E., Murphy, C.J. dan Woodward, P.M, 2012, Chemistry:
The Central Science, 12th Edition, Pearson Education, Inc., Boston.
Campbell, N.A., Reece, J.B., Urry,
L.A., Cain, M.L., Wasserman, S.A., Minorsky, P.V., dan Jackson, R.B., 2010, Biologi, Jilid 1, Edisi 8, terjemahan
oleh Wulandari, D.T., 2010, Erlangga, Jakarta.
Elfita, L., 2014, Analisis Profil
Protein dan Asam Amino Sarang Burung Walet (Collocalia
fuchiphaga) Asal Painan, Jurnal Sains
Farmasi & Klinis, 1(1): 27-37.
Improta, R., Vitagliano, L., dan Esposito,
L., 2011, Peptide Bond Distortions from Planarity: New Insights from Quantum
Mechanical Calculations and Peptide/ Protein Crystal Structures, Public Library of Science (PLOS) ONE, 6(9): 1-10.
Katili, A.S., 2009, Struktur dan
Fungsi Protein Kolagen, Jurnal Pelangi
Ilmu, 2(5): 19-28.
Machin, A., 2012, Potensi Hidrolisat
Tempe sebagai Penyedap Rasa melalui Pemanfaatan Ekstrak Buah Nanas, Biosantifika, 4(2): 70-77.
Mathews, C.K., Holde, K.E.V., dan
Ahern, K.G., 2000, Biochemistry, 3rd
Edition, Benjamin Cummings, San Fransisco.
Murray, R.K., D.A. Bender, K.M.
Botham, P.J. Kennelly, V.W. Rodwell dan P.A. Weil, 2009, Harper’s Illustrated Biochemistry, 28th Edition, The
McGraw-Hill Companies, Inc., New York.
Purwaningsih, S., E. Salamah dan G.P
Apriyana, 2013, Profil Protein dan Asam Amino Keong Ipong-Ipong (Fasciolaria salmo) pada Pengolahan yang
Berbeda, Jurnal Gizi dan Pangan, 8(1): 77-82.
Siddiqui, J.F., 2017, A Review on
General Methods of Analysis of Proteins, World
Journal of Pharmacy anD Pharmaceutical Sciences, 6(11): 597-619.
Tellingen, C.V., 2001, Biochemistry from a Phenomenological Point
of View, Louis Bolk Instituut, Amsterdam.
Walker, S., dan McMahon, D., 2008, Biochemistry Demystified: A Self-Teaching
Guide, The McGraw-Hill Companies, Inc., New York.
Wardiyah, 2016, Kimia Organik, Pusdik SDM Kesehatan, Jakarta Selatan.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)
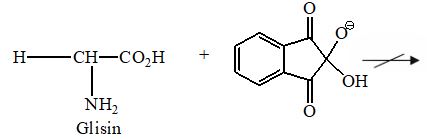









































0 Comment:
Post a Comment