BAB IPENDAHULUAN
1.1 Latar Belakang
Asam amino dianggap sebagai blok pembangun protein (Bhawani dkk., 2012). Protein yang dihidrolisis akan menghasilkan sejumlah besar asam amino. Tiap asam amino pada protein memiliki bentuk yang berbeda satu sama lain. Dua puluh jenis asam amino pada protein dalam tubuh manusia memiliki kuantitas dan kombinasi yang bervariasi (Tellingen, 2001).
Tiap asam amino memiliki rantai samping dengan sifat-sifat fisik dan kimia rantai tertentu. Asam amino dikelompokkan berdasarkan sifat rantai samping, yaitu asam amino dengan rantai samping non polar yang bersifat hidrofobik dan dengan rantai samping polar yang bersifat hidrofilik. Asam amino yang bersifat asam memiliki rantai samping yang umumnya bermuatan negatif, akibat keberadaan gugus karboksil, sedangkan amino yang bersifat basa memiliki gugus amino pada rantai sampingnya yang umumnya bermuatan positif (Campbell dkk., 2010). Asam amino dibagi menjadi asam amino esensial, non esensial, dan esensial bersyarat (Soebagio dkk., 2014).
Salah satu metode identifikasi yang dapat digunakan dalam mengidentifikasi asam amino adalah metode kromatografi lapis tipis (KLT). Metode ini bekerja dengan memisahkan sampel berdasarkan pada perbedaan kepolaran antara sampel dengan pelarut yang digunakan. Semakin kecil kepolaran antara sampel dengan pelarut, maka sampel akan semakin terbawa oleh pelarut (Syamsul dkk., 2018). Berdasarkan uraian tersebut, maka dilakukan pemisahan dan identifikasi asam amino menggunakan metode kromatografi lapis tipis berdasarkan nilai Rf.
1.2 Maksud dan Tujuan Percobaan
1.2.1 Maksud Percobaan
Maksud dari percobaan adalah untuk mengetahui dan memahami cara pemisahan dan identifikasi asam amino menggunakan metode kromatografi lapis tipis.
1.2.2 Tujuan Percobaan
Tujuan dari percobaan adalah sebagai berikut:
- menentukan nilai Rf dari asam amino glisin, alanin, sistein, dan sampel X.
- mengidentifikasi asam amino dalam sampel X berdasarkan nilai Rf.
1.3 Prinsip
Identifikasi asam amino berdasarkan perbedaan nilai Rf dengan menggunakan metode kromatografi lapis tipis yang fase geraknya terdiri dari campuran n-butanol, asam asetat, dan air, sedangkan fase diamnya berupa lapisan tipis alumina (plat KLT).
BAB IITINJAUAN PUSTAKA
2.1 Asam Amino
Asam amino merupakan molekul organik yang memiliki gugus karboksil (-COOH) dan gugus amina (–NH2). Semua asam amino memiliki kesamaan struktur, yaitu bagian tengah struktur terdapat atom karbon (Cα) yang bersifat asimetrik. Atom karbon tersebut berikatan gugus amina, gugus karboksil, atom hidrogen, dan gugus R yang juga disebut sebagai rantai samping. Gugus ini berbeda untuk setiap asam amino (Campbell dkk., 2010). Dua puluh jenis rantai samping tersebut bervariasi, seperti segi ukuran, bentuk, muatan, kapasitas ikatan hidrogen, karakter hidrofobik, dan reaktivitas kimia (Berg dkk., 2002)
Asam amino berikatan satu sama lain dalam rantai polipeptida yang dihubungkan oleh ikatan peptida yang terbentuk diantara 2 gugus fungsional. Satu rantai polipeptida dapat mengandung 10-49 unit asam amino. Namun, ketika rantai polipeptida bergabung dengan rantai polipeptida lainnya akan membentuk 50-3.000 asam amino. Asam amino merupakan penyusun protein (Siddiqui, 2017). Ikatan peptida merupakan kelompok reaktif, yaitu substrat dari sejumlah besar protease (Improta dkk., 2011).
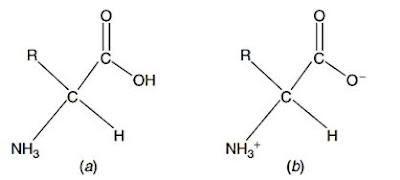
Asam amino dapat berupa zwitter ion. Zwitter ion merupakan substansi yang mengandung jumlah muatan positif dan negatif yang sama. Hal tersebut disebabkan, karena adanya gugus karboksil dan amina yang dapat bermuatan positif maupun negatif (Mathews dkk., 2000). Gugus amina membawa muatan positif (NH3+) dan gugus karboksil membawa muatan negatif (CO2-). Dua muatan tersebut menyebabkan molekul asam amino dapat bersifat asam maupun basa, disebut sebagai amfoter (amphoteric) (Walker dan McMahon, 2008).
Gambar 1. (a) asam amino netral, dan (b) asam amino dalam bentuk zwitter ion (Walker dan McMahon, 2008).
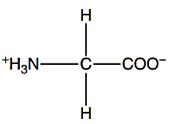
2.1.1 Glisin
Gambar 2. Struktur glisin (Walker dan McMahon, 2008).
Glisin termasuk dalam asam amino yang bersifat netral, nonpolar (hidrofobik), non esensial, dan memiliki rantai samping terbuka, sehingga tergolong sebagai asam amino bersifat alifatik (Rahayu dkk., 2014). Selain itu, glisin memiliki struktur yang paling sederhana (Nelson dan Cox, 2017). Beberapa keunikan glisin yaitu memiliki ukuran struktur yang terkecil, dibandingkan dengan asam amino lainnya. Gugus R merupakan proton tunggal yang bersifat fleksibel, neuroinhibitor, dan berperan dalam mekanisme biosintesis banyak senyawa, contohnya adalah senyawa purin (Walker dan McMahon, 2008). Glisin dapat memproduksi glukosa ketika energi dibutuhkan dan esensial di dalam sintesis purin (Sucandra dkk., 2015).
Terdapat tiga jalur pembentukan glisin. Jalur pertama adalah jalur pembentukan dari serin. Serin memindahkan gugus hidroksimetil ke tetrahidrofolat (THF) sehingga hanya glisin yang tersisa. Glisin juga dibentuk dari karbon dioksida (CO2), amonia dan metilentetrahidrofolat dengan adanya bantuan enzim glisin sintetase. Sedangkan jalur ketiga adalah dengan melibatkan oksidasi dan pemisahan gugus metil dari kolin (Schumm, 1993).
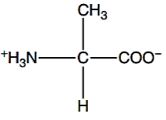
2.1.2 Alanin
Gambar 3. Struktur alanin (Walker dan McMahon, 2008).
Alanin merupakan produk dari metabolisme triptofan. Alanin tergolong inhibitor alosterik dari sintetase glutamin, yaitu enzim yang memegang peran utama dalam metabolisme nitrogen didalam sel juga berpartisipasi dalam reaksi transaminasi dan siklus glukosa-alanin (Mathews dkk., 2000). Alanin merupakan jenis asam amino non esensial, netral, nonpolar pada pH mendekati 7, dan memiliki rantai cabang hidrokarbon alifatik (Rahayu dkk., 2014).
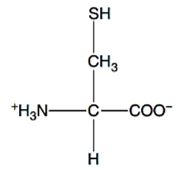
2.1.3 Sistein
Gambar 4. Struktur sistein (Walker dan McMahon, 2008).
Sistein merupakan golongan asam amino non esensial, memiliki struktur kimia alifatik, polar tidak bermuatan, dan bersifat netral (Rahayu dkk., 2014). Selain itu, Walker dan McMahon (2008), menyatakan bahwa keunikan yang dimiliki sistein yaitu meliputi golongan sulfhidril yang ditemukan pada sisi aktif enzim, mengikat besi, dan membentuk jembatan disulfida. Menurut Mathews dkk. (2000), ikatan disulfida berperan dalam menstabilkan struktur dari beberapa protein.
2.2 Kromatografi
Proses pemisahan memiliki peranan penting dalam mengidentifikasi sifat dan fungsi dari komponen individual dalam suatu sampel dalam proses analisa sains. Salah satu teknik yang paling umum digunakan adalah kromatografi. Teknik kromatografi yaitu pemisahan berdasarkan komposisi individual dari campuran pada sifat fisik dan kimia. Pengaplikasian kromatografi dapat dibedakan pada tahap analitikal, persiapan atau proses operasional yang lebih jauh. Selain itu, dapat pula dibedakan dari instrumen ke instrumen tergantung pada besar kecil skala produksi yang dihasilkan (Shintani, 2016).
2.3 Kromatografi Lapis Tipis (KLT)
Identifikasi asam amino dari sampel biologis merupakan suatu yang penting, karena dapat menjelaskan beberapa penyimpangan yang berhubungan dengan berbagai masalah metabolik. Beberapa metode kromatografi telah dikembangkan, salah satunya adalah kromatografi lapis tipis yang memiliki peranan dalam bidang analisis biokimia (Bhawani dkk., 2012). Metode ini merupakan metode kromatografi paling sederhana dan banyak digunakan. Alat dan bahan yang digunakan cukup sederhana. Optimasi metode dan instrumen komersial yang tersedia, pemisahan yang efisien, dan kuantifikasi yang akurat dapat dicapai (Wulandari, 2011).
Pelaksanaan metode meliputi penotolan sampel pada salah satu ujung fase diam (lempeng KLT) agar dapat membentuk zona awal. Setelah dikeringkan, ujung fase diam yang telah ditotol dicelupkan kedalam fase gerak didalam chamber. Fase gerak merupakan pelarut tunggal ataupun campuran dua sampai empat pelarut murni. Jika pemilihan fase diam dan gerak telah sesuai, maka campuran komponen sampel akan bermigrasi dengan kecepatan yang berbeda selama pergerakan fase gerak melalui fase diam, fase gerak telah bergerak sampai jarak yang diinginkan, fase diam diambil dan dilakukan pengeringan kembali. Zona yang dihasilkan kemudian dideteksi secara langsung (visual) atau di bawah sinar ultraviolet (UV), penambahan atau tanpa penambahan pereaksi penampak noda yang cocok (Wulandari, 2011).
Faktor retardasi (Retardation factor = Rf) adalah parameter yang digunakan untuk menggambarkan migrasi senyawa dalam KLT. Nilai menyatakan posisi noda pada fase diam setelah dilakukan proses elusi. Rumus Rf adalah sebagai berikut (Wulandari, 2011):
2.4 Ninhidrin
Ninhidrin merupakan agen pengoksidasi yang kuat dan bereaksi dengan gugus α-amino dari asam amino atau protein. Ninhidrin akan tereduksi menjadi hidridantin ketika bereaksi dengan asam α-amino. Amino akan berubah menjadi aldehida, amonia, dan karbon dioksida. Hidridantin akan bereaksi dengan amonia bebas dan molekul lain dari ninhidrin untuk membentuk kompleks warna ungu. Oleh karena itu, ninhidrin dapat digunakan dalam mengidentifikasi adanya asam amino (Siddiqui, 2017).
BAB III
METODE PERCOBAAN
3.1 Bahan Percobaan
Bahan yang digunakan dalam percobaan ini adalah larutan asam amino (glisin, alanin, sistein, dan sampel X), larutan ninhidrin 2%, eluen (larutan n-butanol, asam asetat, dan akuades), aseton, plat KLT, dan plastik wrap.
3.2 Alat Percobaan
Alat yang digunakan dalam percobaan ini adalah pipa kapiler, chamber, oven, pensil, botol semprot, gelas ukur 10 mL, pipet tetes, gegep, pinset, dan penggaris.
3.3 Prosedur Percobaan
3.3.1 Pembuatan Eluen
Campuran larutan n-butanol, asam asetat, dan akuades dengan perbandingan 2,6 mL; 0,6 mL; dan 2,6 mL dimasukkan kedalam gelas ukur 10 mL. Kemudian dipindahkan ke dalam chamber, lalu chamber ditutup rapat dan dihomogenkan. Lalu chamber dibungkus plastik wrap dan didiamkan selama 30 menit hingga eluen jenuh.
3.3.2 Penotolan Sampel
Plat KLT digunting sesuai ukuran, lalu diberi tanda batas atas dan batas bawah yaitu 1 cm. Selanjutnya plat KLT diberi tanda titik tempat penotolan sampel asam amino. Kemudian plat KLT diaktifkan dalam oven selama 30 menit. Selanjutnya larutan asam amino (glisin, alanin, sistein, dan sampel X) ditotolkan pada plat KLT yang telah diberi tanda titik menggunakan pipa kapiler yang telah dibersihkan terlebih dahulu dengan aseton.
3.3.3 Proses Elusi
Plat KLT yang telah ditotolkan larutan asam amino (glisin, alanin, sistein, dan sampel X) dimasukkan kedalam chamber untuk dielusi. Proses elusi dihentikan ketika eluen telah mencapai batas atas yang telah ditentukan. Kemudian plat KLT dikeluarkan dari chamber dan dikeringkan pada suhu kamar. Selanjutnya, plat KLT disemprot dengan larutan ninhidrin 2%, lalu plat KLT dikeringkan dalam oven.
3.3.4 Identifikasi Asam Amino
Plat KLT yang telah kering akan membentuk noda. Noda yang dihasilkan diberi tanda lingkaran menggunakan pensil, lalu diukur jarak totolan ke noda dan jarak tempuh eluen. Nilai Rf dihitung dengan menggunakan rumus sebagai berikut:
BAB IVHASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan Tabel 1. Data Hasil Pengamatan
No. | Jenis Asam Amino | Jarak Eluen (cm) | Jarak Noda (cm) | Nilai Rf (Praktek) |
1. | Glisin | 3,0 | 1,40 | 0,46 |
2. | Alanin | 3,0 | 1,50 | 0,50 |
3. | Sistein | 3,0 | 1,10 | 0,36 |
4. | Sampel X | 3,0 | 1,30 | 0,43 |
4.2.1 Reaksi Glisin


4.2.2 Reaksi Alanin + Ninhidrin


4.2.3 Reaksi Sistein + Ninhidrin


4.3 Pembahasan
Asam amino merupakan golongan senyawa organik yang memiliki gugus fungsional berupa karboksil dan amino yang terikat pada atom C, yaitu karbon α. Gugus R merupakan rantai samping dari struktur asam amino. Variasi rantai samping pada berbagai aspek membentuk berbagai jenis asam amino. Sekitar 80 jenis asam amino yang telah teridentifikasi, 20 di antaranya terdapat dalam tubuh manusia. Asam amino merupakan penyusun protein. Identifikasi asam amino penting karena dapat memberi kontribusi penting dalam bidang analisis biokimia. Kromatografi merupakan salah satu metode pemisahan melalui prinsip perbedaan kepolaran yang dapat digunakan dalam identifikasi asam amino. Percobaan ini digunakan metode kromatografi lapis tipis (KLT).
Prosedur percobaan terbagi atas 4 tahapan. Tahap pertama adalah pembuatan eluen. Campuran larutan n-butanol, asam asetat, dan akuades dengan perbandingan 2,6 mL; 0,6 mL; dan 2,6 mL adalah sebagai fase gerak. Pemilihan ketiga pelarut didasarkan atas perbedaan kepolaran. Urutan kepolaran yaitu air > n-butanol > asam asetat. Lalu campuran dimasukkan kedalam chamber, lalu dibungkus menggunakan plastik wrap, dengan tujuan untuk menjenuhkan eluen. Eluen yang jenuh dapat mempercepat terjadi proses elusi dengan meningkatkan daya kapilaritas plat KLT. Semakin baik daya kapilaritas plat, maka semakin mudah fase gerak dapat diserap oleh fase diam (plat). Tahap kedua adalah penotolan sampel, plat KLT yang telah digunting sesuai ukuran dan diberi batas atas dan bawah yaitu 1 cm, lalu dimasukkan kedalam oven dengan tujuan pengaktifan. Penotolan sampel digunakan pipa kapiler yang telah dicuci menggunakan aseton. Aseton merupakan senyawa yang bersifat nonpolar, sehingga mudah melarutkan senyawa-senyawa nonpolar lainnya. Selain itu, aseton mudah mengalami penguapan sehingga proses pengeringan lebih efiesien.
Tahap ketiga adalah proses elusi. Plat KLT yang telah ditotol dimasukkan kedalam chamber untuk proses elusi. Setelah mencapai batas atas, plat KLT dikeluarkan. Plat KLT yang dikeringkan pada suhu kamar, kemudian disemprot dengan larutan ninhidrin 2% sebagai reagen yang dapat mengindentifikasi asam amino berdasarkan perubahan warna. Plat KLT kemudian dikeringkan kembali didalam oven agar noda tampak lebih jelas. Tahap akhir yaitu identifikasi asam amino, noda yang terbentuk diberi tanda lingkaran menggunakan pensil dan dilakukan pengukuran jarak noda dari penotolan dan jarak tempuh eluen. Nilai Rf kemudian dihitung berdasarkan nilai yang telah diperoleh.
Berdasarkan hasil pengamatan, diperoleh hasil eluen 3,0 cm. Glisin, jarak noda 1,40 cm dengan nilai Rf adalah 0,46 cm. Alanin, jarak noda adalah 1,50 cm dengan nilai Rf adalah 0,50 cm. Sistein, jarak noda adalah 1,10 cm dengan nilai Rf adalah 0,43 cm. Sedangkan sampel X, jarak noda 1,30 cm dengan nilai Rf 0,43 cm. Nilai Rf sampel X mendekati nilai Rf pada glisin, sehingga larutan sampel X merupakan larutan asam amino glisin. Perbedaan nilai Rf teori dan praktek tersebut, menandakan bahwa telah terjadi penyimpangan. Penyimpangan tersebut dapat disebabkan oleh adanya kesalahan praktikan. Pertama adalah batas bawah yang tidak lebih dari 1 cm, sehingga asam amino ikut terurai dengan eluen. Selain itu, dalam proses penotolan sampel, yaitu totolan yang dibuat terlalu besar.
BAB VKESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan dari percobaan ini adalah sebagai berikut:
- nilai Rf asam glisin, alanin, sistein, dan sampel X secara berturut-turut adalah 0,46 cm, 0,50 cm, 0,36 cm, dan 0,43 cm.
- jenis asam amino dalam sampel X adalah glisin.
5.2 Saran
5.2.1 Saran untuk Laboratorium
Perlu diadakan pengecekan fasilitas laboratorium secara berkala dan perbaikan fasilitas yang rusak, contohnya adalah beberapa westafel yang sudah tidak lagi berfungsi.
5.2.2 Saran untuk Percobaan
Ketelitian dalam melakukan praktikum sangat diperlukan agar mencegah terjadinya penyimpangan. Selain itu, sebaiknya dapat digunakan lebih dari satu jenis metode kromatografi agar praktikan dapat membandingkan hasilnya.
DAFTAR PUSTAKA
Berg, J.M., Tymoczko,
J.L., dan Stryer, L., 2002, Biochemistry,
Fifth Edition, W.H. Freeman, New York.
Bhawani, S.A., Ibrahim,
M. N., Sulaiman, O., Hashim, R., Mohammad, A., dan Hena, S., 2012, Thin-Layer
Chromatography of Amino Acids: A Review, Journal
of Liquid Chromatography & Related Technologies, 35(1): 1497-1516.
Campbell, N.A., Reece,
J.B., Urry, L.A., Cain, M.L., Wasserman, S.A., Minorsky, P.V., dan Jackson, R.B.,
2010, Biologi, Jilid 1, Edisi 8, terjemahan oleh Wulandari, D.T., 2010, Erlangga,
Jakarta.
Improta, R., Vitagliano,
L., dan Esposito, L., 2011, Peptide Bond Distortions from Planarity: New
Insights from Quantum Mechanical Calculations and Peptide/ Protein Crystal
Structures, Public Library of Science
(PLOS) ONE, 6(9): 1-10.
Mathews, C.K.,
Holde, K.E.V., dan Ahern, K.G., 2000, Biochemistry,
Third Edition, Benjamin Cummings, San
Fransisco.
Nelson, D.L. dan
Cox, M.M., 2017, Lehninger Principles of
Biochemistry: International Edition, Seventh
Edition, W.H. Freeman, New York.
Rahayu, M., Pramonowibowo,
dan Yulianto, T., 2014, Profil Asam Amino yang Terdistribusi kedalam Kolom Air
Laut pada Ikan Kembung (Rastrelliger
kanagurta) sebagai Umpan Skala (Skala Laboratorium), Journal of Fisheries Resources Utilization Management and Technology,
3(3): 238-247.
Sen, S., Sarkar, S.,
Kundu, P., dan Laskar, S., 2012, Separation of Amino Acids Based on Thin-Layer Chromatography
by a Novel Quinazoline Based Anti-Microbial Agent, American Journal of Analytical Chemistry, 3(1): 669-674.
Shintani, H., 2016,
Editor’s Note: Journal of Chromatography and Separation Techniques, Journal of Chromatography & Separations
Techniques, 7(6): 1-2.
Siddiqui, J.F.,
2017, A Review on General Methods of Analysis of Proteins, World Journal of Pharmacy adn Pharmaceutical Sciences, 6(11): 597-619.
Soebagio, S.B.,
Soares, J.S., Indraswati, N., dan Kurniawan, Y., 2014., Ekstraksi Polisakarida
pada Biji Tamarind (Tamarindus indica L),
Jurnal Ilmiah Widya Teknik, 13(2): 23-32.
Sucandra, A., Silvina,
F., dan Yulia, A.E., 2015, Uji Pemberian Beberapa Konsentrasi Glisin pada Media
Vacin and Went (VW) Terhadap Pertumbuhan Plantlet Anggrek (Dendrobium sp.) secara In Vitro, Jurnal Online Mahasiwa Fakultas Pertanian, 2(1): 1-11.
Syamsul, E.S.,
Mulyani, R.N., dan Jubaidah, S., 2018, Identifikasi Rhodamin B pada Saus Tomat
yang Beredar di Pasar Pagi Samarinda, Jurnal
Ilmiah Ibnu Sina, 3(1):125-133.
Tellingen, C.V.,
2001, Biochemistry from a
Phenomenological Point of View, Louis Bolk Instituut, Amsterdam.
Walker, S., dan McMahon,
D., 2008, Biochemistry Demystified: A
Self-Teaching Guide, The McGraw-Hill Companies, Inc., New York.
Wulandari, L.,
2011, Kromatografi Lapis Tipis, PT.
Taman Kampus Presindo, Jember.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)















0 Comment:
Post a Comment