
BAB I
PENDAHULUAN
1.1 Latar Belakang
Di kehidupan sehari-hari, jenis alkohol yang banyak dijumpai adalah metanol dan etanol. Alkohol paling sederhana yaitu metanol lebih dikenal sebagai spiritus yang digunakan sebagai bahan bakar. Metanol merupakan bahan yang sangat toksik yang bisa menyebabkan kebutaan bila dikonsumsi dalam jumlah kecil, sedangkan bila dikonsumsi berlebihan metanol akan dapat menyebabkan kematian. Etanol sendiri digunakan sebagai pelarut, desinfektan atau bahan minuman keras (Wardiyah, 2016). Adapun fenol, di bidang industri digunakan sebagai bahan pembuatan plastik, pewarna, dan anestesi (Brown, 2012). Fenol dalam kehidupan sehari-hari juga dikenal sebagai karbol atau lisol yang berfungsi sebagai desinfektan (Wardiyah, 2016). Sifat fenol adalah beracun (toksik) pada jaringan hewan dan berbau sangat menyegat (Koirewoa dan Raunsay, 2016). Selain itu, jumlah fenol yang besar dalam air dapat menyebabkan turunnya kadar oksigen terlarut sehingga menjadikannya sebagai salah satu indikator kualitas air (Lestari, 2013).
Senyawa fenol memiliki kemiripan dengan alkohol. Perbedaannya, senyawa fenol terikat pada gugus aromatik atau gugus aril, sedangkan gugus hidroksil pada senyawa alkohol terikat pada gugus alifatik (Koirewoa dan Raunsay, 2016). Berdasarkan peran dan sifat kedua senyawa di atas, dilakukan beberapa contoh reaksi untuk membedakan senyawa alkohol dan fenol. Hasil dari reaksi akan menunjukkan sifat dari suatu senyawa. Dengan mengetahui sifat alkohol dan fenol, maka penggunaan alkohol dan fenol dapat dilakukan dengan lebih berhati-hati.
1.2 Maksud dan Tujuan Percobaan
1.2.1 Maksud Percobaan
Maksud dari percobaan ini adalah sebagai berikut:
- Mempelajari beberapa sifat fisika dan kimia dari alkohol dan fenol.
- Membedakan antara alkohol primer, sekunder, dan tersier.
1.2.2 Tujuan Percobaan
Tujuan dari percobaan ini adalah sebagai berikut:
- Untuk mengetahui kelarutan beberapa jenis alkohol dan fenol dalam air dan n-heksana.
- Untuk membedakan alkohol primer, sekunder, dan tersier.
- Untuk mengetahui reaksi alkohol dan fenol dengan Na2CO3, NaHCO3,
dan FeCl3.
1.3 Prinsip Percobaan
1.3.1 Kelarutan dalam air dan n-heksana
Prinsip dari percobaan ini adalah menentukan kepolaran alkohol dan fenol melalui pencampuran masing-masing senyawa dengan air dan n-heksana. Jika larut dalam air dan tidak larut dalam n-heksana bersifat polar, jika tidak larut dalam air namun larut dalam n-heksana bersifat nonpolar, sedangkan jika larut di keduanya maka bersifat semipolar.
1.3.2 Membedakan alkohol primer, sekunder dan tersier dengan pereaksi Lucas
Prinsip dari percobaan ini adalah membedakan jenis alkohol primer, sekunder, dan tersier serta fenol (sebagai pembanding) dengan menggunakan pereaksi Lucas di mana kecepatan reaksi dari alkohol primer ke tersier semakin besar.
1.3.3 Reaksi dengan Na2CO3 dan NaHCO3
Prinsip dari percobaan ini adalah membedakan jenis alkohol primer, sekunder, dan tersier serta fenol (sebagai pembanding) dengan menggunakan pereaksi Lucas di mana kecepatan reaksi dari alkohol primer ke tersier semakin besar.
1.3.4 Reaksi dengan FeCl3
Prinsip dari percobaan ini adalah membedakan senyawa alkohol dan fenol dengan mereaksikannya dengan FeCl3 di mana jika terjadi reaksi maka tergolong fenol dan jika tidak bereaksi tergolong alkohol.
2.1 Alkohol
Gambar 1. Struktur alkohol (Koirewoa dan Raunsay, 2016)
Alkohol merupakan derivat hidrokarbon di mana satu atau lebih atom hidrogennya digantikan dengan gugus fungsional -OH, disebut gugus hidroksil atau gugus alkohol (Brown, 2012). Alkohol memiliki rumus umum CnH2n+1OH atau R-OH di mana R merupakan lambang dari senyawa alkil, yaitu hidrokarbon rantai terbuka (Wardiyah, 2016). Dengan mensubstitusikan –OH ke H dari CH4, maka didapat CH3OH yang dikenal sebagai metanol (Yulia et al., 2018).
Alkohol R-OH memiliki bagian hidrofob (R-) dan hidrofil (-OH). Bagian hidrokarbon dari suatu alkohol bersifat hidrofob yakni menolak molekul-molekul air. Makin panjang rantai hidrokarbon maka makin rendah kelarutan alkohol dalam air. Bila rantai hidrokarbon cukup panjang, sifat hidrofobnya akan dapat mengalahkan sifat hidrofil (menyukai air) gugus hidrofil. Peningkatan kelarutan sebanding dengan bertambahnya jumlah gugus hidroksil dalam senyawa. Semakin banyak gugus hidroksil maka kelarutannya semakin tinggi (Wardiyah, 2016). Adapun ikatan O-H merupakan ikatan polar sehingga alkohol dapat larut lebih baik dalam pelarut polar dibanding dalam pelarut alkana. Selain itu, gugus fungsional -OH dapat membentuk ikatan hidrogen. Oleh karenanya titik didih alkohol jauh lebih tinggi dibanding hidrokarbon alkana (Brown, 2012).
Berdasarkan letak gugus OH, alkohol dibedakan atas (Yulia et al., 2018):
- Alkohol primer, bila gugus OH terikat pada gugus OH primer.
- Alkohol sekunder, bila gugus OH terikat pada gugus OH sekunder.
- Alkohol tersier, bila gugus OH terikat pada gugus OH tersier.
Gambar 2. Jenis alkohol berdasarkan letak gugus OH (Hadanu, 2019)
Identifikasi jenis alkohol dapat dilakukan melalui tes Lucas. Reagen Lucas dicampurkan dengan jenis alkohol pada kepolaran yang sama. Tes Lucas mengidentifikasi 3 jenis alkohol di mana alkohol primer ditandai dengan terbentuknya larutan bening, alkohol sekunder ditandai dengan keruhnya larutan setelah 3-5 menit, sedangkan alkohol tersier ditandai dengan kekeruhan diikuti terbentuknya dua lapisan karena terpisahnya alkil halida (Aljamali, 2015).
2.2 Fenol
Gambar 3. Struktur fenol (Koirewoa dan Raunsay, 2016)
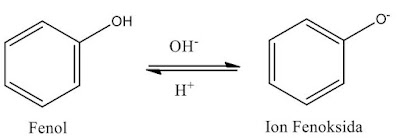
Fenol dikenal sebagai senyawa organik aromatik dengan gugus fungsinya yaitu hidroksil (OH). Perbedaan alkohol dan fenol yaitu gugus OH pada senyawa alkohol terikat pada atom karbon tetrahedral, sedangkan pada fenol gugus OH terikat pada karbon pada cincin aromatik. Sesuai dengan strukturnya, fenol dapat membentuk suatu anion fenoksida dengan melepaskan ion H dari gugus OH ketika bereaksi dengan logam hidrida maupun suatu basa (Koirewoa dan Raunsay, 2016). Dengan terbentuknya anion fenoksida ini, fenol menjadi lebih asam dibandingkan alkohol karena anion yang dihasilkan oleh resonansi, dengan muatan negatifnya disebar (delokalisasi) oleh cincin aromatik (Yulia et al., 2018).
Gambar 4. Delokalisasi muatan pada ion fenoksida (Koirewoa dan Raunsay, 2016)
Seperti air, fenol dapat membentuk ikatan hidrogen. Karena adanya ikatan hidrogen ini, maka fenol mempunyai titik didih yang lebih tinggi dari senyawa lain yang mempunyai berat molekul yang sama. Di samping itu, adanya gugus fungsi hidroksil menyebabkan fenol dapat membentuk ikatan hidrogen dengan air (gugus hidrofil). Pengaruh gugusan –OH yang hidrofil membuat fenol larut dalam air. Perbedaan gugus fungsi yang terikat pada gugus aril, akan menyebabkan perbedaan sifat fisik dari senyawa tersebut (Hadanu, 2019).
Adapun identifikasi fenol dapat dilakukan melalui tes besi klorida. Fenol bereaksi dengan besi (III) klorida atau FeCl3 dan membentuk kompleks warna. Warna yang terbentuk bervariasi, yakni merah, ungu, biru atau hijau, tergantung pada jenis fenol yang digunakan, pelarut, dan konsentrasinya. Namun, beberapa jenis fenol tidak membentuk warna dalam uji ini (Aljamali, 2015).
BAB III
METODOLOGI PERCOBAAN
3.1 Bahan Percobaan
Bahan yang digunakan dalam percobaan ini adalah metanol, 1-butanol, 2-butanol, 2-metil-2-propanol, asam asetat, fenol, akuades, n-heksana, pereaksi Lucas, Na2CO3, NaHCO3, FeCl3, handscoon, dan tisu gulung.
3.2 Alat Percobaan
Alat yang digunakan dalam percobaan ini adalah tabung reaksi, rak tabung, gelas kimia, pipet tetes, dan sikat tabung.
3.3 Prosedur Percobaan
3.3.1 Kelarutan dalam Air dan n-Heksana
Disiapkan 10 buah tabung reaksi yang bersih dan kering. Tabung 1-5 diisi dengan 0,5 mL air sedangkan tabung 6-10 diisi 0,5 mL n-heksana. Ditambahkan 10 tetes metanol ke dalam salah satu tabung berisi air dan n-heksana. Dikocok dan diamati kelarutannya. Tahapan diulangi dengan mengganti metanol menjadi 1-butanol, 2-butanol, 2-metil-2-propanol, dan fenol.
3.3.2 Membedakan Alkohol Primer, Sekunder, dan Tersier dengan Pereaksi Lucas
Disiapkan 4 buah tabung reaksi yang bersih dan kering. Masing-masing tabung reaksi diisi dengan 1 mL reagen Lucas. Ditambahkan alkohol primer ke dalam tabung (1), alkohol sekunder ke tabung (2), alkohol tersier ke tabung (3), dan fenol ke tabung (4). Larutan dikocok, dibiarkan selama 3-5 menit dalam suhu kamar, dan diamati reaksi yang terjadi.
3.3.3 Reaksi Alkohol dan Fenol
3.3.3.1 Reaksi dengan Na2CO3 dan NaHCO3
Disiapkan 4 buah tabung reaksi yang bersih dan kering. Tabung (1) dan (2) diisi dengan 1 mL fenol sedangkan tabung (2) dan (3) diisi dengan 1 mL asam asetat. Ditambahkan 0,5 mL Na2CO3 ke dalam tabung (1) dan (3) sedangkan tabung (2) dan (4) ditambahkan 0,5 mL NaHCO3. Larutan dikocok, dibiarkan selama 3-5 menit dalam suhu kamar, dan diamati reaksi yang terjadi.
3.3.3.2 Reaksi dengan FeCl3
Disiapkan 3 buah tabung reaksi yang bersih dan kering. Tabung (1) diisi dengan 1 mL metanol, tabung (2) diisi 1 mL 2-butanol, dan tabung (3) diisi 1 mL fenol. Selanjutnya ditambahkan beberapa tetes FeCl3 ke dalam masing-masing reaksi. Larutan dikocok dan diamati reaksi yang terjadi.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan Kelarutan dalam Air dan n-Heksana
4.1.1 Data Hasil Pengamatan
Tabel 1. Data hasil pengamatan kelarutan dalam air dan n-heksana
|
No.
|
Alkohol/Fenol
|
Kelarutan dalam
Air
|
Kelarutan dalam n-Heksana
|
Keterangan
|
|
+
Air
|
+
n-Heksana
|
|
1.
|
Metanol
|
Larut
|
Larut
|
Bening
|
Keruh
|
|
2.
|
1-Butanol
|
Larut
|
Larut
|
Keruh, ada
gelembung
|
Bening
|
|
3.
|
2-Butanol
|
Larut
|
Larut
|
Keruh
|
Bening
|
|
4.
|
2-Metil-2-Propanol
|
Larut
|
Larut
|
Bening
|
Bening
|
|
5.
|
Fenol
|
Larut
|
Tidak larut
|
Jingga
|
2 fase (bening dan
jingga)
|
4.1.2 Pembahasan
Dalam praktikum, kelarutan alkohol dan fenol diuji terhadap air dan n-heksana. Berdasarkan teori, gugus OH memiliki sifat polar sedangkan gugus nonpolar dimiliki oleh gugus alkil. Dengan demikian senyawa alkohol berantai pendek (jumlah atom C 1-5) memiliki polaritas yang hampir sama dengan molekul air sehingga akan terbentuk ikatan hidrogen antara atom O dari alkohol dengan atom H dari air, sedangkan senyawa alkohol berantai panjang (jumlah atom C>5) bersifat hidrofobik atau sukar larut dalam air. Dari hasil yang didapatkan, metanol, 1-butanol, 2-butanol, dan 2-metil-2-propanol menunjukkan sifat polar dalam air, begitupun dalam n-heksana. Kekeruhan pada larutan menunjukkan sifat semihomogen (tidak larut dengan sempurna), disebabkan oleh kepolaran yang semakin berkurang seiring dengan bertambahnya jumlah atom C. Kelarutan zat uji dalam kedua pelarut disebut semipolar. Hasil ini tidak sesuai dengan teori di mana keempat zat uji yang polar seharusnya tidak dapat larut dalam n-heksana yang bersifat nonpolar berdasarkan prinsip like dissolves like. Kesalahan dapat terjadi akibat human error atau kualitas zat yang menurun. Adapun fenol menunjukkan sifat larut dalam air namun tidak larut dalam fenol. Gugus hidroksil pada fenol memiliki sifat polar namun gugus fenil yang nonpolar dan bersifat dominan dalam molekul fenol menyebabkan fenol memiliki kelarutan yang terbatas dalam air namun dapat larut sempurna dalam n-heksana. Hasil reaksi yang didapatkan pun tidak sesuai dengan teori.
4.2 Hasil Pengamatan Uji Ninhidrin
4.2.1 Data Hasil Pengamatan
Tabel 2. Data hasil pengamatan perbedaan alkohol primer, sekunder, dan tersier
No. | Alkohol | Pereaksi Lucas | Keterangan |
1. | Primer (1-butanol) | Tidak larut dan terbentuk 2 fasa | Tidak bereaksi |
2. | Sekunder (2-butanol) | Larut | Bereaksi tapi butuh waktu yang lama |
3. | Tersier (2-metil-2-propanol) | Larut | Bereaksi dengan waktu yang sangat cepat |
4. | Fenol (sebagai pembanding) | Tidak larut dan terbentuk 2 fasa | Tidak bereaksi |
4.2.2 Reaksi
1. Butanol

2. 2-Butanol

3. 2-Metil-2-Propanol

4. Fenol

4.2.3 Pembahasan Uji Lucas digunakan untuk membedakan alkohol primer, sekunder, dan tersier berdasarkan reaktivitas ketiga jenis alkohol tersebut. Pereaksi Lucas terdiri atas senyawa ZnCL2 dan HCl pekat yang ketika bereaksi dengan alkohol akan menghasilkan senyawa alkil halida dan air. Namun pada 1-butanol yang merupakan alkohol primer, karbokation yang terbentuk (akibat ikatan Cl pada atom karbon menggantikan yang gugus –OH) tidaklah stabil sehingga sulit untuk bereaksi terhadap pereaksi Lucas. Sedangkan pada alkohol sekunder 2-butanol dan alkohol tersier 2-metil-2-propanol, karbokation yang bersifat stabil lebih mudah bereaksi dalam uji Lucas. Adapun kelarutan pereaksi Lucas dalam 2-metil-2-propanol lebih cepat karena jumlah atom yang menstabilkan karbokation lebih banyak sehingga mempercepat laju reaksi. Dengan demikian urutan kereaktifan ketiga jenis alkohol terhadap pereaksi Lucas adalah alkohol tersier > alkohol sekunder > alkohol primer.
Sementara itu, senyawa fenol tidak dapat larut dalam pereaksi Lucas. Hal ini disebabkan oleh kuatnya ikatan gugus hidroksil pada fenol sehingga sulit untuk diputuskan oleh senyawa yang terkandung dalam pereaksi Lucas. Kuatnya ikatan tersebut akibat adanya delokalisasi elektron oleh resonansi yang terjadi pada struktur aromatik.
4.3 Hasil Pengamatan Reaksi Alkohol dan Fenol
4.3.1 Reaksi dengan Na2CO3 dan NaHCO3
4.3.1.1 Data Hasil Pengamatan
Tabel 3. Data hasil pengamatan reaksi dengan Na2CO3 dan NaHCO3
Zat | Na2CO3 | NaHCO3 | Keterangan |
Na2CO3 | NaHCO3 |
Fenol | Tidak ada gelembung udara dan terjadi 1 fase | Tidak ada gelembung udara dan terjadi 2 fase | Tidak bereaksi | Tidak bereaksi |
Asam asetat | Tidak ada gelembung udara dan terjadi 1 fase | Ada gelembung udara dan terjadi 1 fase | Tidak bereaksi | Bereaksi, tapi memerlukan waktu yang lama. |
Dengan Na2CO31. Fenol

2. Asam Asetat

Dengan NaHCO3
1. Fenol

2. Asam Asetat

4.3.1.3 Pembahasan Uji biuret dilakukan untuk mengidentifikasi protein melalui reaksi dengan ikatan peptida dalam protein. Ketika reagen biuret bercampur dengan protein peptida, terjadi perpindahan hidrogen peptida diikuti pembentukan ikatan kovalen koordinasi ion Cu2+ dari reagen dengan atom nitrogen (N) dari protein. Ikatan ini memunculkan kompleks chelate yang tampak berwarna ungu. Semakin panjang ikatan peptida dari suatu sampel, semakin pekat pula warna kompleks yang tampak. Hasil reaksi yang dilakukan menunjukkan uji positif pada sampel gelatin dan albumin, mengindikasikan kehadiran ikatan peptida.
4.3.2 Reaksi dengan FeCl3
4.3.2.1 Data Hasil Pengamatan Tabel 4. Data hasil pengamatan reaksi FeCl3
Zat | FeCl3 | Keterangan |
Metanol | Hijau lembayung | 1 fasa dan tidak bergelembung |
2-Butanol | Hijau lembayung | 2 fasa, ada gelembung |
Fenol | Ungu kehitaman di permukaan dan merah kehitaman di dasar tabung | Terbentuk 2 fasa serta bergelembung |
1. Metanol

2. 2-Butanol

3. Fenol

4.3.1.3 Pembahasan
Uji FeCl3 digunakan untuk membedakan alkohol alifatik (alkohol) dan alkohol aromatik (fenol) karena reagen ini dapat bereaksi dengan fenol namun tidak dengan alkohol. Ketika fenol ditambahkan dengan FeCl3, Fe3+ berikatan akan dengan fenol sehingga terbentuk kompleks berwarna merah hingga ungu kehitaman. Warna ini tampak pada hasil reaksi fenol dengan FeCl3 sedangkan pada metanol dan 2-butanol, warna larutan menjadi hijau lembayung. Hijau lembayung ini berasal dari warna reagen sehingga mengindikasikan tidak terjadinya reaksi. 2 fase yang tersbentuk pada uji terhadap 2-butanol diduga disebabkan oleh penurunan kualitas senyawa. Adapun terbentuknya 2 fase pada larutan yang fenol, yakni ungu kehitaman dan merah kehitaman diduga akibat pengocokan larutan yang kurang homogen sehingga hasil reaksi lebih tampak pada bagian atas larutan.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan dari percobaan ini adalah sebagai berikut:
- Keempat sampel alkohol (metanol, 1-butanol, 2-butanol, dan 2-metil-2-propanol) menunjukkan sifat larut dalam air dan n-heksana sedangkan fenol hanya larut dalam air. Hasil ini tidak sesuai dengan teori di mana keempat sampel alkohol bersifat polar sedangkan fenol bersifat semipolar.
- Urutan kereaktifan ketiga sampel alkohol terhadap pereaksi Lucas adalah alkohol tersier > alkohol sekunder > alkohol primer.
- Hasil reaksi fenol terhadap Na2CO3 dan NaHCO3 menunjukkan uji negatif, begitupun asam asetat terhadap Na2CO3. Hasil ini tidak sesuai dengan teori yang menyatakan bahwa kedua senyawa tersebut bersifat asam. Sedangkan reaksi fenol terhadap FeCl3 membentuk kompleks berwarna merah hingga ungu kehitaman (positif).
5.2 Saran
5.2.1 Saran untuk Praktikum
Variasi uji identifikasi alkohol dan fenol yang dilakukan di dalam praktikum perlu dipertahankan.
5.2.2 Saran untuk Laboratorium
Sebaiknya ketersediaan bahan kimia dapat dijaga agar praktikum dapat berlangsung sesuai penuntun.
DAFTAR PUSTAKA
Aljamali, N.M., 2015,
Identification Methods of Unknown, International
Journal of Medical Research and Pharmaceutical Sciences, 2(2): 1-7.
Brown, T.L., Lemay, H.E.,
Bursten, B.E., Murphy, C.J. dan Woodward, P.M, 2012, Chemistry: The Central Science, 12th Edition, Pearson
Education, Inc., Boston.
Hadanu, R., 2019, Kimia Organik, Jilid 1, Edisi Pertama,
Penerbit Leisyah, Makassar.
Koirewoa, D.C. dan Raunsay, E.K.,
2016, Status Pencemaran Senyawa Fenol Pada Beberapa Sumber Air Di Distrik
Jayapura Selatan Kota Jayapura, Novae
Guinea: Jurnal Biologi, 8(2):
91-98.
Lestari, M.W., Saputro, S.H.,
Wahyuni, S., 2013, Sintesis dan Karakterisasi Nanokatalis CuO/TiO2
yang Diaplikasikan pada Proses Degradasi Limbah Fenol, Indonesian Journal of Chemical Science, 2(2): 154-159.
Wardiyah, 2016, Kimia Organik, Pusdik SDM Kesehatan,
Jakarta Selatan.
Yulia, R., Nurman, S., dan
Sunartaty, R., 2018, Eksperimen Kimia
Organik, Universitas Serambi Mekkah, Banda Aceh.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)








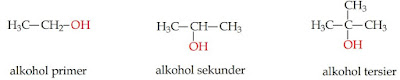















0 Comment:
Post a Comment