Daftar Isi
DASAR TEORI
Pengidentifikasian jenis mikroba dapat dilakukan berdasarkan sifat-sifat yang dimilikinya setelah diperoleh biakan murni. Karakterisasi bakteri umumnya dilakukan berdasarkan karakteristik morfologi, fisiologi, dan biokimia. Uji yang digunakan dalam identifikasi bakteri tidaklah sama untuk semua kelompok. Adapun sifat memfermentasikan laktosa merupakan ciri utama dalam identifikasi Enterobacteriaceae.
Karakteristik
morfologi dapat diketahui dengan dua cara, yaitu secara makroskopik dan
mikroskopik. Pengamatan makroskopik dilakukan untuk mengamati karakteristik
koloni bakteri hasil inokulasi pada media NA datar di dalam cawan petri berdasarkan
bentuk koloni, elevasi, tepian, dan warna koloni. Sedangkan pengamatan
mikroskopik dilakukan untuk melihat bentuk sel serta sifat fisiologis maupun
biokimia bakteri. Pengamatan mikroskopik meliputi pewarnaan Gram, uji katalase,
dan uji biokimia. Sifat metabolisme bakteri dalam uji biokimia biasanya dilihat
dari interaksi metabolit-metabolit yang dihasilkan dengan reagen-reagen kimia.
Selain itu, pengamatan mikroskopik juga dilakukan melalui pengujian suhu dan
pH.
PROSEDUR KERJA
a. Morfologi
Koloni
- Isolat bakteri Escherichia coli diinokulasikan menggunakan metode gores kuadran ke media NA dalam cawan petri.
- Media diinkubasi selama 1 × 24 jam.
- Media kultur yang telah ditumbuhi bakteri diamati menggunakan mikroskop untuk melihat sifat-sifat koloninya.
b. Morfologi Sel
- Isolat bakteri E. coli diinokulasikan dari media NA ke kaca preparat.
- Preparat olesan bakteri difiksasi menggunakan bunsen.
- Diteteskan Gram A (zat kristal violet) sebanyak 2-3 tetes lalu dibiarkan selama 1 menit.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Diteteskan Gram B (larutan JKJ) lalu dibiarkan selama 1 menit.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Diteteskan Gram C (alkohol) lalu dibiarkan selama 30 detik.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Diteteskan Gram D (zat safranin) lalu dibiarkan selama 30 detik.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Preparat diamati menggunakan mikroskop dengan perbesaran 1000× dibantu minyak imersi.
c. Uji Katalase
- Isolat bakteri dari media NA diinokulasikan ke kaca preparat.
- Ditetesi dengan peroksida berupa H2O2.
- Diamati perubahan yang terjadi.
d. Uji Triple Sugar Iron Agar (TSIA)
- Diambil isolat bakteri E. coli dari stok.
- Diinokulasikan ke dalam media agar miring TSIA menggunakan metode tusuk dan gores sinambung.
- Diinkubasikan selama 1 × 24 jam.
e. Uji Methyl Red (MR)
- Diambil isolat bakteri E. coli dari stok
- Diinokulasikan ke dalam media MR menggunakan ose bulat.
- Diinkubasikan selama 5 × 24 jam.
- Ditetesi reagen Methyl Red dan diamati perubahan yang terjadi.
f. Uji Voges-Proskauer
(VP)
- Diambil isolat bakteri E. coli dari stok.
- Diinokulasikan ke dalam media VP menggunakan ose bulat.
- Diinkubasikan selama 3 × 24 jam.
- Ditetesi dengan 5% α-naphtol dan 40% KOH.
- Diamati perubahan yang terjadi.
g. Uji Sitrat
- Diambil isolat bakteri E. coli dari stok.
- Diinokulasikan ke dalam media agar miring Simmons Citrate menggunakan metode gores sinambung.
- Diinkubasikan selama 1 × 24 jam.
- Diamati perubahan yang terjadi.
h. Uji Indol
- Diambil isolat bakteri E. coli dari stok.
- Diinokulasikan ke dalam media SIM menggunakan ose bulat.
- Diinkubasikan selama 1 × 24 jam.
- Ditetesi dengan reagen Kovac's.
- Diamati perubahan yang terjadi.
i. Uji Motilitas
- Diambil isolat bakteri E. coli dari stok.
- Diinokulasikan ke dalam media SIM menggunakan metode tusuk.
- Diinkubasikan selama 1 × 24 jam.
- Diamati perubahan yang terjadi.
j. Uji Pengaruh pH
- Diambil isolat bakteri E. coli dari stok.
- Diinokulasikan ke dalam media NB pH 3, 7, dan 9.
- Diinkubasikan selama 1 × 24 jam.
- Diamati perubahan yang terjadi.
k. Uji Pengaruh
Suhu
- Diambil isolat bakteri E. coli dari stok.
- Diinokulasikan ke dalam 3 tabung media NB.
- Diinkubasikan selama 1 × 24 jam pada suhu berbeda, yakni 15 °C, 37 °C, dan 45 °C.
- Diamati perubahan yang terjadi.
HASIL DAN PEMBAHASAN
a. Morfologi Koloni
Secara teori,
koloni yang tampak di permukaan agar berasal dari spora atau sel vegetatif
tunggal dari mikroorganisme yang sama. Koloni mikroba seringkali memiliki
penampakan khusus yang membedakannya dengan jenis mikroba lain. Pengamatan
terhadap morfologi koloni meliputi bentuk koloni, bentuk permukaan (elevasi),
tepian, dan warna koloni. Bentuk koloni dibagi menjadi circular (bulat), irregular
(tidak beraturan), dan rhizoid
(pertumbuhan menyebar seperti akar). Tepian luar koloni (margin) meliputi entire
(rata), lobate (berlekuk), undulate (bergelombang), serrate (bergerigi), dan filamentous (tepi melebar seperti
benang). Elevasi merupakan derajat kenaikan pertumbuhan koloni di atas
permukaan agar yang dikelompokkan menjadi flat
(rata), raised (timbul), convex (cembung), dan umbonate (cembung di bagian tengah lebih
menonjol). Pengamatan morfologi koloni dapat dilakukan dengan bantuan
mikroskop.
 |
| Gambar 1. Hasil pengamatan morfologi koloni E. coli pada media NA |
Pengamatan
terhadap koloni E. coli dilakukan
dengan menggunakan mikroskop stereo. Pada Gambar
1., tampak koloni E. coli
memiliki tipe bentuk bulat (circular)
berwarna putih kekuningan, margin rata (entire),
dan dengan tipe elevasi cembung (convex).
Hasil ini sesuai dengan penelitian Arrizqiyani dan Nurlina (2016) di mana hasil
penanaman E. coli pada media EMBA
menunjukkan karakter serupa, namun dengan warna koloni yang berbeda di mana
pada media NA berwarna putih kekuningan sedangkan pada media EMBA berwarna ungu
tua dengan kilap hijau metalik. Begitupun pada hasil pertumbuhan E. coli pada media Blood Agar yang dilakukan oleh Bajrami dan Sulaj (2017) di mana
didapatkan koloni E. coli dengan
bentuk circular berwarna putih
keabu-abuan dengan kilap logam, elevasi convex,
dan dengan tepian entire.
b. Morfologi Sel
Bakteri sulit
untuk dilihat dengan menggunakan mikroskop cahaya karena tidak dapat mengadsorpsi
dan membiaskan cahaya. Alasan inilah yang menyebabkan zat warna digunakan untuk
mewarnai bakteri. Zat warna mengadsorpsi dan membiaskan cahaya sehingga kontras
bakteri dengan sekelilingnya ditingkatkan. Terdapat beberapa jenis teknik
pewarnaan mikroba, di antaranya adalah dengan menggunakan metode pengecatan
Gram. Pewarnaan Gram dapat membedakan bakteri menjadi 2 kelompok, yakni bakteri
Gram-positif dan Gram-negatif. Prinsip pewarnaan Gram adalah berdasarkan pada kemampuan
dinding sel terhadap zat warna dasar (kristal violet) setelah pencucian dengan
alkohol. Bakteri Gram-positif terlihat berwarna ungu karena dinding selnya
mengikat zat kristal violet dengan kuat, sedangkan sel Gram-negatif mengandung
lebih banyak lipid sehingga pori-pori mudah membesar dan kristal violet mudah
larut saat pencucian dengan alkohol.
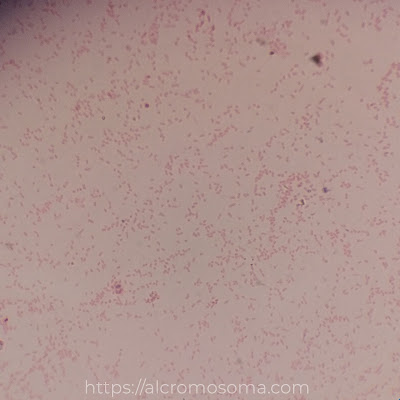 |
| Gambar 2. Hasil Pengecatan Gram Escherichia coli |
Hasil pengecatan
yang dilihat pada Gambar 2.
menunjukkan jenis bakteri Gram-negatif dengan bentuk sel batang pendek
(kokobasil). Hal ini ditentukan berdasarkan pada warna sel bakteri yang tampak
setelah pengecatan, yakni merah muda, menandakan bahwa bakteri E. coli tidak mampu mengikat zat kristal
violet sehingga terwarnai oleh zat safranin. Metode serupa dilakukan oleh Kumar
et al. (2017) di mana hasil
pengecatan bakteri jenis E. coli
menunjukkan penampakan bentuk sel batang pendek berwarna merah muda. Selain
itu, menurut Widyaningsih et al.
(2016) dari hasil pengamatan dengan mikroskop, sel bakteri E. coli berbentuk batang. Menurutnya, bakteri E. coli yang merupakan bakteri Gram-negatif memberikan respon warna
merah disebabkan karena kandungan lapisan membran luar berupa peptidoglikan
yang tipis. Membran ini terdiri atas lipida, polisakarida, dan protein. Oleh
karena struktur peptidoglikannya yang tipis, cat utama (kristal violet) akan
lepas setelah dilakukan dekolorisasi sehingga tergantikan dengan cat lawan
(safranin).
c. Uji Katalase
Uji katalase
merupakan suatu pengujian terhadap bakteri tertentu untuk mengetahui apakah
bakteri tersebut merupakan bakteri aerob, anaerob fakultatif, atau anaerob
obligat. Pengujian tersebut berdasarkan pada kemampuan bakteri memproduksi
enzim katalase yang dapat memecah H2O2 menjadi H2O
dan O2. Enzim katalase diduga penting untuk pertumbuhan aerobik
karena H2O2 dapat menghambat pertumbuhan bakteri sehingga
bersifat racun terhadap sel bakteri.
 |
| Gambar 3. Hasil Uji Katalase Escherichia coli |
Dalam praktikum,
pemberian peroksida (H2O2) pada bakteri E. coli menyebabkan munculnya gelembung
yang merupakan bentuk dari H2O dan O2. Hadirnya gelembung
mengindikasikan telah terjadinya pemecahan H2O2 oleh
enzim katalase (positif). Hal ini sesuai dengan penelitian serupa yang
dilakukan oleh Bawole et al. (2018)
di mana uji positif pada uji katalase terhadap E. coli ditandai dengan terbentuknya gelembung-gelembung oksigen,
menunjukkan adanya produksi enzim katalase. Menurut Zaid et al.. (2003) dalam jurnalnya, E.
coli memiliki 2 enzim katalase, yakni HP I dan HP II yang dapat mengkatalisis
dekomposisi H2O2.
d. Uji Triple Sugar Iron Agar (TSIA)
Uji TSIA digunakan untuk membedakan beberapa
jenis bakteri Enterobacteriaceae yang bersifat Gram-negatif. Pengelompokan
tersebut didasarkan pada kemampuan bakteri dalam memfermentasikan gula yang
akan membentuk asam dan produksi H2S sehingga dapat dibedakan dengan
bakteri Gram-negatif lainnya. Media ini memiliki 3 jenis gula dalam
kandungannya, yaitu 1% sukrosa, 1% laktosa, dan 0,1% glukosa. Konsentrasi ini
akan berpengaruh terhadap penggunaan karbohidrat dan keadaan asam yang terbentuk.
Indikator pH, yaitu phenol red,
ditambahkan untuk menunjukkan adanya perubahan pH akibat fermentasi
karbohidrat. Sedangkan indikator H2S adalah FeSO4 untuk
memperlihatkan pembentukan H2S yang ditunjukkan dengan timbulnya
endapan hitam.
 |
| Gambar 4. Hasil Uji TSIA Escherichia coli |
Dalam praktikum, pertumbuhan bakteri E. coli pada media TSIA menyebabkan perubahan warna media dari warna merah menjadi kuning. Hasil tersebut menunjukkan bahwa bakteri E. coli dapat memfermentasikan 3 jenis gula, yakni glukosa, sukrosa, dan laktosa. Di samping itu, terbentuknya gas dari fermentasi asam format menyebabkan media menjadi pecah. Pecahnya media disebabkan karena asam format teroksidasi sempurna oleh enzim hidrogenase sehingga menghasilkan H2 dan CO2. H2 inilah yang tidak larut pada media sehingga terakumulasi di sepanjang jalur inokulasi. Hal ini didukung oleh Aditi et al. (2017) di mana fermentasi gula diindikasikan dengan perubahan warna media TSIA menjadi kuning, sedangkan pembentukan gas pada butt akan memunculkan gelembung atau pecahnya media.
Adapun dari hasil
pengujian tidak terdapat endapan hitam yang mengindikasikan produksi H2S.
Hasil ini tidak sesuai dengan literatur di mana
Fe yang terdapat dalam bentuk FeSO4 pada media akan berikatan
dengan H2S. H2S terbentuk dari penggabungan H2
dan S dari penguraian asam amino sistein dan metionin oleh desulfurasi enzim.
Reaksi H2S dengan Fe membentuk FeS yang ditampilkan sebagai endapan
hitam (Litaay et al., 2007).
e. Uji Methyl Red (MR)
Beberapa bakteri memfermentasikan glukosa dan
menghasilkan berbagai produk yang bersifat asam sehingga akan menurunkan pH
media pertumbuhannya. Melalui uji MR, adanya fermentasi asam campuran oleh
bakteri yang diuji dapat diketahui. Media akan berwarna merah pada lingkungan dengan pH 4,4 dan berwarna
kuning dalam lingkungan dengan pH ≥6. Penambahan indikator pH methyl red dapat menunjukkan adanya
perubahan pH menjadi asam.
 |
| Gambar 5. Hasil Uji MR Escherichia coli |
Uji methyl red dilakukan untuk mengetahui
ada tidaknya aktivitas fermentasi asam campuran oleh bakteri E. coli. Asam campuran tersebut terdiri
atas asam laktat, asam suksinat, asam malat, dan asam format. Adapun dari hasil
praktikum didapatkan hasil yang berbeda pada kedua tabung, di mana tabung I
menunjukkan hasil negatif sedangkan pada tabung II menunjukkan hasil positif.
Hasil negatif ditandai dengan warna yang tetap pada media, yakni kuning, karena
tidak terjadi perubahan pH pada media. Menurut penelitian yang dilakukan oleh
Ginting et al. (2018), E. coli dapat memproduksi asam campuran
sehingga pH yang dihasilkan ≤4,4. Oleh karena adanya perubahan pH menjadi asam,
maka reaksi MR menyebabkan media berubah warna menjadi merah. Hal ini diperkuat
oleh El-Hadedy dan El-Nour (2012) bahwa pembiakan E. coli pada media MR menunjukkan hasil positif. Adapun adanya
penyimpangan pada tabung I dapat disebabkan oleh kesalahan dalam proses
inokulasi.
f. Uji Voges-Proskauer (VP)
Uji VP merupakan
salah satu metode yang digunakan untuk mendeteksi bakteri enterik. Penambahan α
-naphtol dan KOH pada media VP dilakukan sebagai indikator adanya asetoin (asetil
metil karbonil) sebagai senyawa pendahulu dalam sintesis 2,3-butanadiol. Pada
penambahan KOH, adanya asetoin ditunjukan dengan perubahan warna media cair
menjadi merah muda. Perubahan warna ini kemudian diperjelas dengan penambahan
larutan α -naphtol.
 |
| Gambar 6. Hasil Uji VP Escherichia coli |
Tujuan
dilakukannya uji VP adalah untuk mendeteksi produksi asetoin (senyawa pendahulu
sistesis 2,3-butanadiol) pada media kultur bakteri. Dengan penambahan α-naphtol
dan KOH, deteksi asetoin ditunjukkan dengan perubahan warna media menjadi warna
merah. Pada hasil uji VP yang dilakukan, tidak terjadi perubahan warna sebagai indikasi tidak dihasilkannya asetoin. Hasil ini didukung oleh penelitian yang dilakukan oleh Arrizqiyani dan Nurlina (2016) di mana pengujian
VP pada media kultur E. coli
menunjukkan hasil negatif. Menurutnya, asetoin akan teroksidasi menjadi
diasetil oleh karena penambahan KOH dan oksigen dari udara. Diasetil akan
ditunjukkan oleh α-naphtol dan reaksinya terhadap asam amino yang terdapat
dalam media, berupa warna merah kecoklatan sampai ungu pada media. Sementara
itu, E. coli tidak dapat membentuk
asetil metil karbinol (asetoin). Metode serupa juga dilakukan oleh El-Hadedy
dan El-Nour (2012) di mana hasil uji VP pada E. coli menunjukkan hasil negatif.
g. Uji Sitrat
Media yang
digunakan untuk pengujian ini adalah media Simmons Citrat. Uji ini dilakukan
untuk mengetahui kemampuan bakteri dalam memfermentasi sitrat sebagai
satu-satunya sumber karbon menjadi natrium karbonat. Reaksi positif berupa
perubahan warna hijau media menjadi warna biru, sedangkan reaksi negatif tidak
menyebabkan perubahan warna pada media.
 | |
|
Bila bakteri dalam
kultur mampu tumbuh dengan menggunakan sitrat sebagai satu-satunya sumber
karbon, maka warna media Simmons Citrate dalam bentuk agar miring akan berubah
menjadi warna biru. Dalam praktikum, perubahan ini tampak pada media Simmons
Citrate setelah inkubasi, menunjukkan hasil positif terhadap penggunaan sitrat.
Hasil ini tidak sesuai dengan penelitian oleh Aref et al. (2018) yang hasilnya negatif terhadap bakteri E. coli. Begitupun pada Rifta et al. (2016) yang melakukan metode
serupa. Menurutnya, bakteri tertentu yang memanfaatkan sitrat sebagai sumber
karbon menghasilkan natrium karbonat yang bersifat alkali, sementara itu E. coli tidak memanfaatkan sitrat
sehingga pada penanaman media hasilnya negatif. Namun demikian, penelitian oleh
Hidayati et al. (2016) menunjukkan
reaksi positif pada uji sitrat terhadap bakteri E. coli asehingga disimpulkan bahwa pada strain tertentu, bakteri E. coli dapat menggunakan sitrat.
h. Uji Indol
Uji indol
merupakan salah satu uji biokimia yang digunakan untuk menentukan kemampuan
mikroba dalam mengonversi triptofan menjadi senyawa indol karena tidak semua
bakteri mampu membentuk indol. Pemecahan triptofan dikatalisis oleh bantuan
enzim triptofanase yang dibentuk oleh bakteri. Dengan penambahan reagen
Kovac's, maka keberadaan senyawa indol akan bereaksi dengan kandungan dalam
reagen Kovac's dan membetuk warna merah pada media.
 |
| Gambar 8. Hasil Uji Indol |
Perubahan warna
media menjadi merah adalah indikasi bahwa bakteri E. coli dapat memproduksi senyawa indol, tetapi pada hasil
praktikum didapatkan hasil negatif. Hasil ini bertolak belakang dengan hasil
penelitian Mursyida dan Yulnefia (2018), di mana bakteri E. coli memiliki kemampuan untuk menghidrolisis asam amino
triptofan menjadi indol dan piruvat melalui kerja enzim triptofanase, sehingga pada
media SIM akan didapatkan reaksi positif. Hasil positif juga didapatkan oleh
El-Hadedy dan El-Nour (2012) di mana penanaman bakteri E. coli pada media SIM bereaksi positif, ditunjukkan dengan
terbentuknya cincin merah pada media. Warna merah tersebut berasal dari reaksi
indol dengan para-dimetilaminobenzaldehid yang terkandung dalam reagen Kovac's.
i. Uji Motilitas
Tidak semua jenis
bakteri bersifat motil, artinya ada yang memiliki flagel (motil) dan adapula
yang tidak memiliki flagel (non-motil). Penanaman bakteri E. coli dalam media SIM yang bersifat semi-solid bertujuan untuk
mengetahui ada tidaknya flagel pada bakteri tersebut. Uji postif ditandai
dengan adanya pertumbuhan yang menyebar di sekeliling area tusukan atau adanya
penyebaran yang berwarna putih seperti akar disekitar jalur inokulasi.
 |
| Gambar 9. Hasil Uji Motilitas |
Pada media semi-solid
SIM, bakteri dengan flagela masih dapat bergerak sehingga sifat motilitas pada
bakteri dapat diamati. Adanya pergerakan bakteri pada media ditandai dengan
terbentuknya penyebaran koloni di sekitar tusukan seperti yang dapat diamati
pada Gambar 9.. Hasil ini telah
sesuai dengan literatur, di mana pada media SIM, bakteri E. coli positif terhadap uji motilitas (Shah et al., 2013). Begitupun oleh Hananto et al. (2015) di mana pertumbuhan E. coli pada media SIM menunjukkan persebaran koloni menyerupai
kabut pada bekas tusukan.
j. Uji Pengaruh pH
Bakteri
membutuhkan pH yang optimal untuk pertumbuhannya. Perubahan pH lingkungan akan
berpengaruh terhadap efektivitas enzim dalam membentuk kompleks enzim substrat.
Menurunnya proses aktivitas enzim turut serta pada penurunan laju pertumbuhan
bakteri. Untuk mengetahui pH optimal bagi pertumbuhan bakteri, bakteri dapat
dibiakkan pada media dengan pH yang berbeda-beda. Media dengan tingkat
kekeruhan paling tinggi menunjukkan kondisi optimal bagi jenis bakteri tersebut
untuk tumbuh.
 |
| Gambar 10. Hasil Uji Pengaruh pH Escherichia coli |
Pada uji pengaruh
pH, bakteri E. coli dibiakkan pada
media NB dengan pH 3, 7, dan 9. Tingkat kepadatan sel bakteri pada media cair
dilihat berdasarkan tingkat kekeruhan. Berdasarkan hal tersebut, dalam
praktikum didapatkan pH optimal untuk pertumbuhan E. coli adalah 7. Sementara
itu, tabung dengan kandungan sel terendah adalah pada pH 3, menunjukkan bahwa
pada pH tersebut, laju metabolisme E. coli
sangatlah rendah. Hasil yang didapatkan sesuai dengan hasil pengujian pada
literatur bahwa pH optimal bagi pertumbuhan E.
coli berada pada jarak pH 6-7 (Czajkowska et al., 2005). Sedangkan menurut Faridz et al. (2007), E. coli
memiliki pH optimal adalah 7-7,5 dengan pH minimum 4 dan pH maksimum 9.
k. Uji Pengaruh Suhu
Suhu merupakan
faktor fisik yang berpengaruh pada laju pertumbuhan bakteri, di antaranya
terhadap reaksi kimia dan stabilitas struktur molekul protein. Pada suhu
optimal, bakteri dapat beradaptasi untuk hidup dan tumbuh dengan baik. Reaksi
kimia akan meningkat dengan meningkatnya suhu karena peningkatan suhu
menyebabkan peningkatan energi kinetik reaktan. Selain itu, suhu yang terlalu
tinggi dapat menyebabkan denaturasi enzim. Adapun penentuan suhu optimal dapat
dilakukan dengan pembiakan bakteri pada suhu yang bervariasi.
 |
| Gambar 11. Hasil Uji Pengaruh Suhu |
Variasi suhu yang
digunakan dalam praktikum untuk mengetahui suhu optimal E. coli adalah 15 °C, 37 °C, dan 45 °C. Kekeruhan yang tampak pada
media NB diurutkan dari yang paling tinggi, yakni 37 °C - 45 °C – 15 °C. Dari
data tersebut diketahui bahwa suhu optimal bagi pertumbuhan E. coli adalah pada suhu ruang (37 °C).
Hasil yang sama didapatkan oleh Nakajima et
al. (2012) di mana laju kelangsungan hidup E. coli paling tinggi pada suhu kultivasi 37 °C. Selain itu, data
yang sama juga diperoleh oleh Faridz et al.
(2007) bahwa suhu optimal bagi pertumbuhan E.
coli adalah 37 °C dengan suhu minimum 10 °C dan suhu maksimum 45 °C.
Aditi, F.Y., Rahman, S.S., & Hossain,
M.M., 2017. A Study on the Microbiological Status of Mineral Drinking Water. The Open Microbiology Journal, 11,
pp.31-44.
Aref, N.E.M., Abdel-Raheem, A.R.A.,
Kamaly, H.F., & Hussien, S.Z., 2018. Clinical and Sero-Molecular
Characterization of Escherichia coli
with an Emphasis on Hybrid Strain in Healthy and Diarrheic Neonatal Calves in
Egypt. Open Veterinary Journal, 8(4),
pp.351-359.
Arrizqiyani, T. & Nurlina, L., 2016.
Identifikasi Bakteri Escherichia coli
pada Cincau Hitam yang Dijual di Pasar Cikurubuk Tasikmalaya. Jurnal Kesehatan Bakti Tunas Husada: Jurnal
Ilmu-ilmu Keperawatan, Analis Kesehatan dan Farmasi, 16(1), pp.188-196.
Bajrami, E. & Sulaj, K., 2017.
Occurrence of Pseudomonas aeruginosa
in Homemade Fresh Butter in Some Rural Areas in Kosovo. Eurasian Journal of Veterinary Sciences, 33(2), pp.73-76.
Bawole, K.V., Umboh, S.D., & Tallei,
T.E., 2018. Uji Ketahanan Bakteri Asam Laktat Hasil Fermentasi Kubis Merah (Brassica oleracea L.) pada pH 3. Jurnal MIPA, 7(2), pp.20-23.
Czajkowska, D., Witkowska-Gwiazdowska, A.,
Sikorska, I., Boszczyk-Maleszak, H., & Horoch, M., 2005. Survival of Escherichia coli Serotype O157:H7 in Water
and in Bottom-Shore Sediments. Polish
Journal of Environmental Studies, 14(4), pp.423-430.
El-Hadedy, D. & El-Nour, S.A., 2012.
Identification of Staphylococcus aureus
and Escherichia coli Isolated from
Egyptian Food by Conventional and Molecular Methods. Journal of Genetic Engineering and Biotechnology, 10(1),
pp.129-135.
Faridz, R., Hafiluddin, & Anshari, M.,
2007. Analisis Jumlah Bakteri dan Keberadaan Escherichia coli Pada Pengolahan
Ikan Teri Nasi di PT. Kelola Mina Laut Unit Sumenap. Jurnal Embryo, 4(2), pp.94-106.
Ginting, S.T.M., Helmi, T.Z., Darmawi, D.,
Dewi, M., Erina, E., Daud, R., & Hennivanda, H., 2018. Isolasi dan Identifikasi
Bakteri Gram Negatif pada Ambing Kambing Peranakan Etawa (PE). Jurnal Ilmiah Mahasiswa Veteriner, 2(3),
pp.351-360.
Hananto, W., Rudyanto, M.D., &
Suardana, I.W., 2015. Isolasi dan Identifikasi Escherichia coli O157:H7 pada Sapi Bali di Kuta Selatan, Badung,
Bali. Indonesia Medicus Veterinus, 4(4),
pp.351-361.
Kumar, S., Kumar, M., Raj, A., &
Prakash, J., 2017. Evaluation of Genetic Analysis of escherichia coli Isolated from Two Different Environmental Sources:
Sewage Water Verses Soiled Bedding Materials of Laboratory Rodents. Brazilian Archives of Biology and Technology,
60, pp.1-10.
Litaay, M., Gobel, R.B., Abdullah, A.,
& Subair, 2007. Identifikasi Awal Bakteri pada Juwana Trochus niloticus Linn. dan Tridacna
squamosa Linn. Asal Hatchery Pulau Barrang Lompo Makassar. Biota: Jurnal Ilmiah Ilmu-Ilmu Hayati, 12(3),
pp.145-152.
Mursyida, E. & Yulnefia, 2018. Deteksi
Bakteri Coliform dan Escherichia coli
dari Air Minum Jajanan Anak di Salah Satu Sekolah Dasar Kota Pekanbaru. Collaborative Medical Journal (CMJ), 1(2),
pp.1-10.
Nakajima, T., Kurita, H., Yasuda, H.,
Takashima, K., & Mizuno, A., 2012. The Relation of E. coli Growth Phase and Low-Temperature He Plasma Jet Exposure. International Journal of Plasma Enviromental
Science & Technology, 6(2), pp.189-193.
Rifta, R., Budiyono, & Darundiati,
Y.H., 2016. Studi Identifikasi Keberadaan Escherichia
coli pada Es Batu yang Digunakan oleh Pedagang Warung Makan di Tembalang. Jurnal Kesehatan Masyarakat (Undip), 4(2),
pp.176-185.
Shah, Q.A., Bibi, F., & Shah, A.H.,
2013. Anti-Microbial Effects of Olive Oil and Vinegar against Salmonella and
Escherichia coli. The Pacific Journal of
Science and Technology, 14(2), pp.479-486.
Widyaningsih, W., Supriharyono, &
Widyorini, N., 2016. Analisis Total Bakteri Coliform di Perairan Muara Kali
Wiso Jepara. Management of Aquatic Resources
Journal (MAQUARES), 5(3), pp.157-164.
Zaid, T., Srikumar, T.S.N., & Benov,
L., 2003. Growth of Escherichia coli
in Iron-Enriched Medium Increases HPI Catalase Activity. Journal of Biochemistry and Molecular Biology, 36(6), pp.608-610.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)













0 Comment:
Post a Comment