
Daftar Isi
TUJUAN PRAKTIKUM
- Mengetahui teknik pewarnaan mikroorganisme.
- Mengetahui teknik pewarnaan sederhana pada bakteri.
- Mengetahui teknik pewarnaan diferensial pada bakteri.
- Mengetahui teknik pewarnaan pada jamur.
DASAR TEORI
Bakteri sulit dilihat menggunakan mikroskop cahaya karena tidak mengabsorpsi atau membiaskan cahaya. Alasan inilah yang menyebabkan zat warna digunakan untuk mewarnai bakteri atau latar belakangnya. Zat warna mengabsorpsi dan membiaskan cahaya sehingga kontras bakteri dengan sekelilingnya ditingkatkan (Lay, dalam Jiwintarum, dkk., 2016). Terdapat beberapa jenis teknik pewarnaan mikroba, di antaranya adalah sebagai berikut:
1. Pewarnaan negatif
Pewarnaan negatif adalah proses pewarnaan yang hanya menggunakan pewarna asam untuk mewarnai latar belakang objek. Disebut pewarnaan negatif karena pewarna yang digunakan adalah pewarna asam yang merupakan ion negatif. Pewarna asam yang sering dipakai adalah negrosin. Negrosin tidak dapat melekat pada permukaan sel bakteri sehingga hanya dapat terlihat sebagai latar belakang bakteri (Murwani, 2015).
2. Pewarnaan sederhana
Pewarna yang digunakan dalam pewarnaan sederhana adalah satu pewarna tunggal dalam bentuk cairan atau terlarut dalam alkohol. Pada pewarnaan ini hanya dapat dilihat bentuk seluler dan bentuk dasar bakteri. Beberapa pewarna yang sering digunakan pada pewarnaan sederhana adalah metilen biru, karbon fuksin, kristal violet, dan safranin. Warna bakteri sesuai dengan pewarna yang digunakan (Murwani, 2015).
3. Pewarnaan Gram
Pewarnaan Gram adalah pewarnaan diferensial yang paling sering digunakan dalam laboratorium mikrobiologi. Tujuan pewarnaan Gram adalah untuk mengetahui perbedaan bakteri Gram-positif dan Gram-negatif berdasarkan perbedaan reaksi yang timbul pada dinding sel. Pada bakteri Gram-negatif, pewarna utama (kristal violet) akan terbilas oleh alkohol akibat kandungan peptidoglikan yang sedikit. Oleh karena itu, pada pengamatan akhir menggunakan mikroskop, bakteri Gram-negatif menampakkan warna zat pendamping (safranin), yakni merah muda. Sementara itu, pada bakteri Gram-positif, dinding sel yang kaya peptidoglikan akan memerangkap pewarna utama (kristal violet) sehingga sel bakteri Gram-negatif tampak berwarna ungu. Cara pewarnaan Gram bakteri adalah dengan meneteskan keempat larutan Gram secara bergiliran, yakni Gram A (kristal violet), Gram B (larutan JKJ), Gram C (alkohol), dan Gram D (safranin) (Rahayu dan Gumilar, 2017).
4. Pewarnaan endospora
Endospora adalah struktur yang tahan terhadap keadaan lingkungan yang ekstrim seperti kering, pemanasan, dan keadaan asam. Endospora berbentuk sangat padat dan refraktil karena memiliki kandungan air yang sangat rendah. Bakteri yang memiliki endospora sangat sulit diwarnai sehingga dibutuhkan pewarnaan spesifik. Pewarna spesifik yang sering digunakan adalah malachite green. Bakteri yang menghasilkan spora akan mengikat kuat senyawa pewarna yaitu malachite green sehingga ketika dilakukan pewarnaan selanjutnya menggunakan safranin, sel spora tidak dapat berikatan dengan pewarna lain karena sudah berikatan dengan malachite green. Oleh karena itu warna bakteri spora adalah hijau. Bakteri yang tidak memiliki spora cenderung tidak tahan terhadap pengecatan karena hanya memiliki sel vegetatif. Saat diwarnai dengan malachite green, sel vegetatif akan mampu berikatan dengan pewarna tersebut tetapi dapat dilunturkan setelah dilakukan pencucian karena tidak berikatan kuat dengan zat pewarna. Oleh karena itu, ketika dilakukan pengecatan dengan menggunakan safranin, akan terbentuk ikatan dengan zat warna yang dihasilkan sehingga ketika diamati oleh mikroskop akan menunjukkan warna merah muda (Assani, dalam Pratita dan Putra, 2012).
Dalam pewarnaan endospora, dua metode yang umumnya digunakan adalah metode Schaeffer Fulton dan metode Klein. Perbedaan kedua metode tersebut didasarkan pada zat warna yang digunakan. Metode Schaeffer Fulton menggunakan zat warna malachite green dan safranin seperti yang telah diuraikan sebelumnya, sedangkan metode Klein menggunakan zat warna karbon fuksin dan metilen biru. Namun metode yang paling sering digunakan adalah metode Schaeffer Fulton karena waktu pewarnaan yang lebih cepat dibandingkan metode lainnya (Oktari, dkk,. 2017).
5. Pewarnaan jamur
Dalam teknik pewarnaan jamur, isolat jamur pertama-tama dikultur menggunakan metode slide culture. Object glass diletakkan di atas besi/kaca bengkok berbentuk U pada cawan petri. Di atas gelas objek diberikan balok agar berukuran 1×1 cm lalu ditutup menggunakan kaca penutup (deck glass). Untuk menjaga kelembapan, ditambahkan sedikit air pada cawan petri. Setelah diinkubasi beberapa hari, diambil gelas objek bersih lalu ditambahkan 1 tetes lactophenol cotton blue dan ditutup dengan kaca penutup yang telah ditumbuhi jamur. Preparat kemudian dapat langsung diamati menggunakan mikroskop (Summerbell, dalam Andreas, 2016).
Menurut Dwyana (2019), hal yang penting diperhatikan dalam pewarnaan mikroorganisme khususnya bakteri antara lain:
- Fiksasi, yakni berfungsi untuk mencegah mengkerutnya protein sel, mengubah afinitas cat, mematikan bakteri dengan cepat tanpa mengubah bentuk dan strukturnya, melekatkan bakteri di atas object glass, dan lain-lain.
- Peluntur cat, yakni berfungsi untuk mendapatkan kontras yang baik pada bayangan mikroskop. Contohnya adalah alkohol yang merupakan peluntur cat yang lemah.
- Zat Mordan, yakni zat pengintensif yang menyebabkan cat terikat lebih kuat pada jaringan sel. Terdapat Mordan basa dan Mordan asam. Contoh Mordan basa adalah FeSO4 dan kalium antimonium tartar. Sedangkan contoh Mordan asam adalah asam tanin, asam pikrat, dan JKJ.
- Cat penutup, yakni berfungsi untuk memberi kontras pada sel yang tidak mengisap cat utama pada akhir pengecatan. Contoh cat penutup adalah metilen biru, safranin, dan eritrosin.
METODE PERCOBAAN
Pewarnaan Gram
1. Alat dan Bahan
Alat-alat yang digunakan dalam teknik pewarnaan Gram adalah object glass, ose bulat, bunsen, pipet tetes, timer, dan mikroskop. Sedangkan bahan pewarnaan Gram adalah isolat bakteri, Gram A, B, C, dan D, akuades, tisu, dan minyak imersi.
2. Prosedur Kerja
- Preparat olesan bakteri difiksasi menggunakan bunsen.
- Diteteskan Gram A sebanyak 2-3 tetes lalu dibiarkan selama 1 menit.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Diteteskan Gram B lalu dibiarkan selama 1 menit.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Diteteskan Gram C lalu dibiarkan selama 30 detik.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Diteteskan Gram D lalu dibiarkan selama 30 detik.
- Preparat dicuci dengan akuades dan dikeringkan menggunakan tisu.
- Preparat diamati menggunakan mikroskop dengan perbesaran 1000× dibantu minyak imersi.
3. Jenis Reagen
Dalam praktikum ini, 4 jenis reagen pewarnaan Gram yang digunakan adalah sebagai berikut:
- Gram A, yakni zat warna kristal violet sebagai zat utama.
- Gram B, yakni JKJ sebagai zat penguat atau pengintensifan melekatnya sel bakteri dengan meningkatkan afinitas pada komponen sel terhadap pewarnaan.
- Gram C, yakni alkohol sebagai bahan dekolorisasi.
- Gram D, yakni zat warna safranin sebagai zat lawan atau zat pembanding.
Pewarnaan Endospora
1. Alat dan Bahan
Alat-alat yang digunakan dalam teknik pewarnaan endospora adalah object glass, ose bulat, bunsen, pipet tetes, timer, dan mikroskop. Sedangkan bahan-bahan yang digunakan dalam teknik pewarnaan endospora adalah isolat bakteri, alkohol, malachite green, safranin, akuades, tisu, dan minyak imersi
2. Prosedur Kerja
- Object glass dibersihkan dengan alkohol lalu dipanaskan menggunakan bunsen.
- Dibuat suspensi homogen bakteri pada object glass dalam akuades steril dan diratakan kurang lebih 1 cm.
- Object glass dikeringanginkan lalu sel bakteri difiksasi menggunakan bunsen.
- Ditetesi malachite green berlebihan lalu dipanaskan langsung dengan api dan bunsen sampai keluar uap. Pemanasan diatur jangan sampai terjadi pengeringan. Dibiarkan selama 10 menit.
- Preparat dicuci dengan akuades mengalir selama 1 menit.
- Ditetesi safranin dan dibiarkan selama 1 menit.
- Preparat dicuci dengan akuades mengalir dan dikeringanginkan.
- Preparat diamati menggunakan mikroskop dengan perbesaran 1000× dibantu minyak imersi.
Pewarnaan Jamur
1. Alat dan Bahan
Alat-alat yang digunakan dalam teknik pewarnaan jamur adalah object glass, deck glass, cawan petri, batang U, cotton swab, enkas, spuit, dan mikroskop. Sedangkan bahan-bahan yang digunakan dalam teknik pewarnaan jamur adalah biakan jamur, media PDA, akuades, tisu, dan laktofenol biru.
2. Prosedur Kerja
- Object glass diletakkan di atas batang U dalam cawan petri yang telah diisi tisu yang dibasahi oleh akuades.
- Dibuat media slide culture PDA menggunakan spuit.
- Jamur diinokulasikan menggunakan metode swab.
- Cawan petri ditutup lalu diinkubasi selama 1×24 jam.
- Hasil inkubasi ditetesi larutan laktofenol biru dan ditutup menggunakan deck glass.
- Preparat diamati menggunakan mikroskop.
HASIL DAN PEMBAHASAN
1. Hasil Pewarnaan Gram
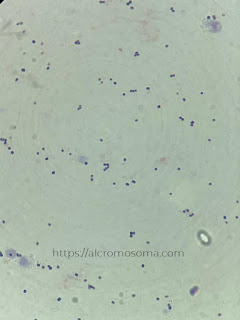 |
| Hasil pengamatan bakteri Gram-positif |
Hasil pengamatan mikroskop yang telah dilakukan menunjukkan bakteri kokus jenis Gram-positif, ditandai dengan warna akhir pewarnaan adalah ungu. Bakteri Gram-positif memiliki lapisan peptidoglikan yang tebal dalam struktur dinding selnya (Sunatmo, dalam Safrida, dkk., 2012). Adanya peptidoglikan yang tebal tersebut dapat menahan zat warna utama yakni kristal violet, sehingga warna utama tidak lepas oleh dekolorisasi dengan alkohol. Cat utama yang tertinggal dalam dinding sel bakteri Gram-positif kemudian akan mencegah bakteri terwarnai oleh safranin sehingga tampak bahwa akhir dari pewarnaan adalah warna ungu.
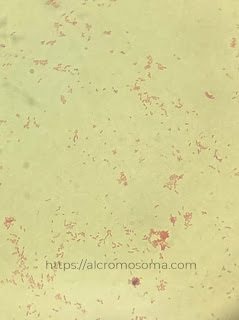 |
Hasil pengamatan bakteri Gram-negatif
|
Hasil pengamatan mikroskop menunjukkan bahwa isolat merupakan bakteri Gram-negatif, ditandai dengan warna merah yang artinya bakteri tersebut tidak mampu mengikat safranin. Berdasarkan literatur, sifat dinding sel bakteri Gram-negatif adalah memiliki lapisan peptidoglikan yang tipis (Sunatmo, dalam Safrida, dkk., 2012). Oleh karena memiliki lapisan peptidoglikan yang tipis, zat kristal violet akan lepas ketika dilakukan dekolorisasi oleh alkohol. Zat warna utama kemudian akan digantikan dengan zat warna pembanding, yakni safranin, sehingga warna akhir dari pewarnaan bakteri Gram-negatif adalah merah. Adapun dari pengamatan bentuk sel, tampak bahwa sel bakteri memiliki bentuk sel kokus (bulat).
 |
| Hasil pengamatan bakteri Gram-negatif |
Hasil pengamatan mikroskop menunjukkan sel berwarna merah yang menandakan bahwa jenis bakteri yang diamati hanya dapat mengikat safranin. Bakteri yang mengikat cat pembanding (safranin) disebut sebagai bakteri Gram-negatif. Adapun pengamatan bentuk sel tidak dapat dilakukan karena jumlah bakteri yang terlalu banyak (tidak ada sel tunggal atau sel terpisah).
2. Hasil Pewarnaan Endospora
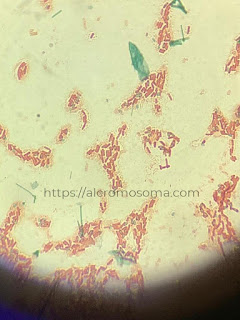 |
| Hasil pengamatan endospora bakteri |
Hasil pengamatan menunjukkan adanya sel-sel bakteri berbentuk basil (merah). Dapat pula dilihat endospora (warna hijau) yang dihasilkan oleh bakteri. Endospora tidak mudah ditembus zat warna. Menurut Lay, dalam Fitrah, dkk. (2013) pewarnaan spora memerlukan pemanasan agar zat warna dapat meresap ke dalam spora. Zat warna pertama merupakan malachite green yang akan mewarnai endospora menjadi hijau dan safranin sebagai zat warna kedua yang akan mewarnai sel vegetatif menjadi merah. Zat warna malachite green tidak berikatan erat dengan dinding sel dan sitoplasma sehingga mudah terlepas sewaktu dilakukan pencucian dengan akuades. Sebaliknya, akuades tidak dapat menembus dinding endospora sehingga tetap berwarna hijau.
3. Hasil Pewarnaan Jamur
 |
Gambar A
|
 |
| Gambar B |
Gambar A merupakan hasil pengamatan jamur yang telah dilakukan. Tampak bahwa didapatkan hasil yang tidak bagus. Hal ini dikarenakan adanya kesalahan dalam proses pembuatan slide culture jamur jenis Aspergillus niger di mana media PDA pada object glass diduga terlalu sedikit sehingga pertumbuhan jamur terhambat. Selain itu, tisu yang kurang basah menghasilkan kondisi yang kurang lembap sementara telah diketahui bahwa jamur membutuhkan suasana lembap untuk tumbuh. Adapun Gambar B merupakan hasil pengamatan dari kelompok berbeda dengan jenis jamur yang diamati adalah sama, yakni Aspergillus niger. Dari gambar tampak morfologi Aspergillus niger yang jelas menampakkan konidia dan konidiofor.
DAFTAR PUSTAKA
Andreas, M.A., 2016. Identifikasi dan Prevalensi Jamur pada Ikan Gurami (Osphronemus gouramy) di Pasar Modern Surabaya. Skripsi. Universitas Airlangga, Surabaya.
Campbell, Neil
A., Jane B. Reece, Lisa A. Urry, Michael L. Cain, Steven A. Wasserman, Peter V.
Minorsky, & Robert B. Jackson. 2010. Biologi,
Edisi 8, Jilid 1. Jakarta: Erlangga.
Dwyana, Z.,
2019. Penuntun Praktikum Mikrobiologi
Umum. Universitas Hasanuddin, Makassar.
Fitrah, I.D.,
2013. Isolasi Pasteurella multocida pada
Kuda dan Sensitivitasnya terhadap Antibiotik. Jurnal Medika Veterinaria, 7(2),
pp.121-125.
Jiwintarum, Y.,
Rohmi, R., & Prayuda, I.D.P.M., 2018. Dragon Fruit (Hylocereus polyrhizus) as Natural Dyes Staining for Bacteria. Jurnal Kesehatan Prima, 10(2), pp.1726-1734.
Oktari, A.,
Supriatin, Y., Kamal, M., & Syafrullah, H., 2017. The Bacterial
Endospore Stain on Schaeffer Fulton Using Variation of Methylene Blue Solution.
Journal of Physics: Conference Serie, 812(1),
p.012066).
Pratita, M.Y.E.
& Putra, S.R., 2012. Isolasi dan Identifikasi Bakteri Termofilik dari
Sumber Mata Air Panas di Songgoriti Setelah Dua Hari Inkubasi. Jurnal Teknik Pomits, 1(1), pp.1-5.
Rahayu, S.A.,
& Gumilar, M.M.H., 2017. Uji Cemaran Air Minum Masyarakat Sekitar Margahayu
Raya Bandung dengan Identifikasi Bakteri Escherichia
coli. Indonesian Journal of
Pharmaceutical Science and Technology, 4(2), pp.50-56.
Safrida, Y.D.,
Yulvizar, C., & Devira, C.N., 2012. Isolasi dan Karakterisasi Bakteri Berpotensi Probiotik pada Ikan Kembung (Rastrelliger
sp.). DEPIK: Jurnal Ilmu-Ilmu Perairan,
Pesisir, dan Perikanan, 1(3), pp.200-203.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)



















0 Comment:
Post a Comment