Daftar Isi
DASAR TEORI
Populasi mikroorganisme di biosfer relatif konstan, yang mana pertumbuhan diimbangi dengan kematian. Kehidupan mikroba di dalam lingkungan dikatakan berhasil apabila dapat berkompetisi untuk mendapatkan dan memanfaatkan nutrisi yang ada di lingkungannya serta kemampuan bertahan hidup di saat kekurangan nutrisi. Pada organisme uniseluler, pertumbuhannya dilihat dari peningkatan jumlah individu dalam populasi atau dalam pembenihan (Murwani, 2015).
Pertumbuhan bakteri dipelajari dengan
mengamati kurva pertumbuhan pada kultur bakteri. Setiap bakteri memiliki kurva
standar pertumbuhan bakteri. Metode perhitungan jumlah sel yang dapat digunakan
dalam pembuatan kurva standar adalah dengan menggunakan spektrofotometer untuk
melihat tingkat kekeruhan (Optical
Density) yang terbaca melalui nilai absorbansi yang dihasilkan.
Terdapat 2 jenis kultur yang menunjukkan garis kurva pertumbuhan yang berbeda, yakni batch culture (biakan sistem tertutup) dan continuous culture (biakan sistem terbuka). Pada batch culture, nutrisi dan kondisi lainnya disiapkan untuk pembiakan di mana inokulum ditambahkan dan dilakukan inkubasi. Selanjutnya tidak dilakukan penambahan nutrisi dan produk buangan hasil metabolisme tidak dikeluarkan (terakumulasi di dalam media) sehingga kondisi lingkungan dalam kultur secara terus-menerus mengalami perubahan. Akibatnya, pada kurva akan tampak garis dengan arah yang berubah-ubah. Sedangkan pada continuous culture, konsentrasi nutrisi dan kondisi lainnya dipertahankan secara konstan sehingga sel akan mengalami pertumbuhan secara eksponensial. Hal ni dikarenakan pada continuous culture, penambahan nutrisi dilakukan secara berkala dan pH dapat dimonitor maupun diatur. Akibatnya, pada kurva akan tampak garis pertumbuhan yang eksponensial atau logaritmik (Hogg, 2005).
 |
| Gambar 1. Kurva Pertumbuhan Batch Culture |
 |
| Gambar 2. Kurva Pertumbuhan Continuous Culture |
Bakteri jika dipindahkan ke dalam suatu media, maka mula-mula bakteri tersebut akan mengalami fase lag (adaptasi) untuk menyesuaikan diri dengan kondisi lingkungan di sekitarnya (Middlebeak et al., dalam Setyati et al., 2015). Panjang atau pendeknya fase lag sangat ditentukan oleh jumlah sel yang diinokulasikan, kondisi fisiologis dan morfologis bakteri, serta media kultivasi yang sesuai (Fardiaz, dalam Setyati et al., 2015). Setelah fase lag adalah fase logaritmik (eksponensial), yakni fase di mana bakteri mengalami pertumbuhan secara cepat dan konstan. Fase eksponensial sel banyak menghasilkan zat-zat metabolisme yang dibutuhkan dalam memenuhi kebutuhannya dalam rangka pertumbuhan. Kecepatan pertumbuhan pada fase ini sangat dipengaruhi oleh media tempat tumbuhnya seperti pH dan kandungan nutrien, begitu pun kondisi lingkungan termasuk suhu dan kelembapan udara (Setyati et al., 2015).
Fase selanjutnya adalah fase stasioner di
mana jumlah populasi sel tetap karena jumlah sel yang membelah sama dengan
jumlah sel yang mati. Ukuran sel pada fase stasioner menjadi lebih kecil karena
sel tetap melakukan pembelahan meskipun zat-zat nutrisi media sudah mulai
habis. Berikutnya adalah fase kematian, yakni terjadi penurunan laju
pertumbuhan yang disebabkan oleh kekurangan materi pertumbuhan seperti vitamin
dan unsur mineral (Gaman dan Sherrington, dalam Setyati et al., 2015). Kematian juga dapat disebabkan oleh berkurangnya
beberapa nutrien esensial dalam media atau karena terjadinya akumulasi
autotoksin dalam media atau kombinasi dari keduanya (Setyati et al., 2015).
Media kompleks maupun media minimal mengandung eleman penting untuk pertumbuhan mikroorganisme non-selektif. Media kompleks merupakan media tak terdefinisi dan memiliki kandungan nutrisi yang tinggi seperti gula dan asam amino sehingga sebagian besar jenis bakteri dapat tumbuh dengan mudah dalam media ini. Sedangkan media minimal merupakan media terdefinisi yang menyediakan jumlah nutrisi yang terbatas sehingga pertumbuhan mikroorganisme dalam media ini menjadi lebih lambat. Penelitian Eevers et al. (2015) membandingkan pertumbuhan bakteri dalam media kompleks dan media minimal dan didapatkan bahwa pertumbuhan bakteri dalam media kompleks menunjukkan jumlah organisme yang lebih tinggi dibandingkan pada media minimal.
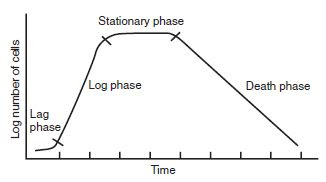 |
| Gambar 3. Fase Kurva Pertumbuhan Bakteri |
METODE KERJA
Alat-alat yang digunakan dalam praktikum ini adalah tabung reaksi, rak tabung, spuit, ose bulat, rotary shaker, erlenmeyer, spektrofotometer, dan bunsen. Sementara itu, bahan-bahan yang digunakan meliputi isolat bakteri Escherichia coli, media NB, media M9, kertas grafik semilogaritma, aluminium foil, dan tisu.
Prosedur Kerja
a. Peremajaan Bakteri (Batch Culture)
Tahap ini bertujuan untuk mengadaptasikan isolat bakteri pada media cair sebleum dilakukan pengukuran kurva pertumbuhan. Disiapkan media NB (Nutrient Broth) dan media minimal M9, kemudian masing-masing diinokulasikan kultur bakteri sebanyak 1 ose. Selanjutnya diinkubasi menggunakan rotary shaker selama 1 × 24 jam dengan kecepatan 120 rpm.
b. Pengukuran Pertumbuhan Populasi Bakteri
Sebanyak 1 mL kultur bakteri yang telah diremajakan diinokulasikan kembali pada media yang sama, yaitu masing-masing media NB dan media M9, kemudian diinkubasi menggunakan rotary shaker dengan kecepatan 120 rpm. Pengamatan pertumbuhan dilakukan setiap 3 jam hingga diperoleh nilai T0 – T9. Pengukuran pertumbuhan dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 580 nm.
c. Pertumbuhan Kurva Pertumbuhan
Hasil pengukuran pertumbuhan bakteri yang diukur menggunakan spektrofotometer selanjutnya dicari nilai densitas optiknya (DO) dengan menggunakan rumus:
HASIL DAN PEMBAHASAN
Kultur Bakteri E. coli pada media NB
T0
Kondisi media = Belum tampak kekeruhan
pada media karena kandungan sel bakteri yang masih sedikit.
%T = 98
DO = 2 – log 98 = 0,01
Fase = Merupakan fase pertumbuhan
dipercepat, yakni fase di mana bakteri telah teraklimatisasi terhadap
lingkungan barunya dan telah menyintesa enzim untuk memulai pembelahan (Hogg,
2005).
T4
Kondisi media = Telah tampak kekeruhan
pada media karena adanya proses pembelahan yang konstan pada fase log.
%T = 9
DO = 2 – log 9 = 1,05
Fase = Merupakan fase stasioner, yakni
fase di mana jumlah sel yang mati dan tumbuh adalah sama (Nakajima et al., 2012).
T9
Kondisi media = Media semakin keruh akibat
pertambahan jumlah sel daripada fase sebelumnya.
%T = 22
DO = 2 – log 22 = 0,66
Fase = Merupakan fase kematian, yakni
disebabkan oleh habisnya nutrien esensial dan akumulasi senyawa ototoksik
(Setyati et al., 2015).
Kultur Bakteri E. coli pada media M9
T0
Kondisi media = Belum tampak kekeruhan
pada media karena kandungan sel bakteri yang masih sedikit.
%T = 99
DO = 2 – log 99 = 0,01
Fase = Merupakan fase pertumbuhan
dipercepat, yakni fase di mana bakteri telah teraklimatisasi terhadap
lingkungan barunya dan telah menyintesa enzim untuk memulai pembelahan (Hogg,
2005).
T4
Kondisi media = Media agak keruh karena
pertambahan jumlah sel dari laju pembelahan yang konstan pada fase log.
%T = 74
DO = 2 – log 74 = 0,13
Fase = Merupakan fase stasioner, yakni
fase di mana jumlah sel yang mati dan tumbuh adalah sama (Nakajima et al., 2012).
T9
Kondisi media = Media semakin keruh akibat
pertambahan jumlah sel.
%T = 76
DO = 2 – log 76 = 0,12
Fase = Merupakan fase kematian, yakni
disebabkan oleh habisnya nutrien esensial dan akumulasi senyawa ototoksik
(Setyati et al., 2015).
Tabel
1.
Hasil Pengukuran Pertumbuhan Bakteri E.
coli pada Media NB dan M9
|
Interval
Waktu |
&T |
NB |
M9 |
|
|
NB |
M9 |
|||
|
T0 |
98 |
99 |
2 – log 98 = 0,01 |
2 – log 99 = 0,01 |
|
T1 |
60 |
94 |
2 – log 60 = 0,22 |
2 – log 94 = 0,03 |
|
T2 |
26 |
81 |
2 – log 26 = 0,59 |
2 – log 81 = 0,09 |
|
T3 |
14 |
80 |
2 – log 14 = 0,85 |
2 – log 80 = 0,10 |
|
T4 |
9 |
74 |
2 – log 9 = 1,05 |
2 – log 74 = 0,13 |
|
T5 |
13 |
74 |
2 – log 13 = 0,86 |
2 – log 74 = 0,13 |
|
T6 |
13 |
70 |
2 – log 13 = 0,86 |
2 – log 70 = 0,16 |
|
T7 |
13 |
76 |
2 – log 13 = 0,86 |
2 – log 76 = 0,12 |
|
T8 |
40 |
95 |
2 – log 40 = 0,40 |
2 – log 95 = 0,02 |
|
T9 |
22 |
76 |
2 – log 22 = 0,66 |
2 – log 76 = 0,12 |
 |
| Kurva Pertumbuhan Bakteri E. coli pada media NB Waktu generasi: 180/5 × 5 = 180 menit = 3 jam |
 |
| Kurva Pertumbuhan Bakteri E. coli pada media M9 Waktu generasi: 180/5 × 4,5 = 162 menit = 2 jam 42 menit |
Laju pertumbuhan bakteri dapat dilihat
dengan membuat kurva pertumbuhan berdasarkan nilai absorbansinya. Prakultur Escherichia coli diinkubasi selama 12
jam sebelum dipindahkan ke dalam media kultur yang sama. Tujuan pembuatan
prakultur adalah agar mikroba dapat beradaptasi terhadap media pertumbuhan
(Hariati et al., 2018). Pengukuran
nilai absorbansi menggunakan spektrofotometer dilakukan dalam interval waktu 3
jam hingga didapatkan nilai T0-T9. Jenis kurva yang digunakan adalah kurva
pertumbuhan tertutup dengan menggunakan media kompleks NB dan media minimal M9.
Alasan digunakannya kedua media tersebut adalah untuk membandingkan laju
pertumbuhan bakteri E. coli dalam dua
jenis media yang berbeda berdasarkan kelengkapan kandungan nutriennya.
Nilai Densitas Optik (DO) ditentukan
berdasarkan nilai transmitannya (%T). Nilai DO yang didapatkan kemudian diplot
ke dalam kertas grafik semilogaritma hingga didapatkan grafik pertumbuhan E. coli pada media. Grafik menunjukkan
fase pertumbuhan yang dimulai dari fase pertumbuhan dipercepat. Fase
pertumbuhan dipercepat adalah fase di mana bakteri telah teraklimatisasi
terhadap lingkungan barunya dan telah menyintesa enzim untuk memulai pembelahan
(Hogg, 2005). Fase pertumbuhan dipercepat diikuti oleh fase logaritmik/eksponensial,
di mana bakteri E. coli membelah
dengan cepat dan konstan. Pada fase ini sel banyak menghasilkan zat-zat
metabolit yang dibutuhkan dalam memenuhi kebutuhannya dalam rangka pertumbuhan
(Setyati et al 2015). Setelah itu
terjadi transisi dari fase logaritmik ke fase stasioner karena adanya
perhambatan pertumbuhan akibat penipisan jumlah nutrien, akumulasi senyawa
buangan, dan kongesti. Di fase stasioner, jumlah sel yang mati dan tumbuh adalah
sama sehingga menunjukkan garis yang lurus atau stasioner (Nakajima et al., 2012). Kekurangan nutrien esensial
serta akumulasi senyawa ototoksik menyebabkan terjadinya penurunan laju
pertumbuhan, disebut fase kematian (Setyati et
al., 2015). Adapun pada media NB, setelah fase pertumbuhan dipercepat (T0),
fase logaritmik terjadi hingga pada T3, diikuti oleh fase stasioner hingga pada
T7 dan fase kematian dimulai setelahnya. Sedangkan pada media M9, fase
pertumbuhan dipercepat (T0) diikuti oleh fase logaritmik hingga pada T2. Fase stasioner dimulai hingga T7 dan diikuti
oleh fase kematian.
Setelah didapatkan kurva pertumbuhan E. coli, maka dilakukan perhitungan
waktu generasi. Waktu generasi adalah selang waktu yang dibutuhkan bagi sel
untuk membelah diri atau untuk populasi menjadi berjumlah dua kali lipat. Waktu
yang diperlukan untuk pembelahan tersebut berbeda-beda pada tiap jenis bakteri
(Aminuddin dan Habib, 2009). Dalam praktikum, waktu generasi yang didapatkan
untuk bakteri E. coli pada media NB
adalah 3 jam dan 2 jam 42 menit pada media M9. Hasil tersebut menunjukkan bahwa
laju pertumbuhan bakteri E. coli pada
media M9 lebih efektif dibandingkan pada media NB. Hal ini dapat dikaitkan
dengan perbedaan komposisi pada kedua media di mana media NB memiliki kandungan
nutrien yang kompleks sedangkan pada media M9 bersifat terbatas (Eevers et al., 2015). Menurut Supriatin dan Rahayyu (2016), beberapa
jenis bakteri dapat hidup dengan baik pada media yang sangat sederhana, yakni
hanya mengandung garam anorganik ditambah sumber karbon organik seperti gula, tetapi
ada pula bakteri yang memerlukan suatu media yang sangat kompleks di mana
selain mengandung sumber karbon dan nitrogen juga perlu penambahan darah atau
bahan-bahan kompleks lainnya. Sementara itu, Paliy dan Gunasekera (2007)
menyebutkan bahwa media M9 pada umumnya tidak dapat mendukung pertumbuhan E. coli sehingga diperlukan penambahan
senyawa tertentu, seperti besi sulfat. Adapun tumbuhnya E. coli pada media minimal M9 dapat terjadi pada beberapa strain
yang mengalami mutasi. Hal ini berdasarkan pada Conrad et al. (2010) di mana E. coli
yang ditumbuhkan dalam media minimal M9 mengalami mutasi berupa delesi gen rpoC
pada RNAP. Mutasi ini menyebabkan E. coli
dapat tumbuh 60% lebih cepat pada media minimal dan tumbuh 30% lebih lambat
pada media kompleks. Strain E. coli
lain yang telah teradaptasi untuk hidup pada media minimal adalah E. coli strain BL21 (Paliy dan
Gunasekera, 2007)
Laju pertumbuhan bakteri menunjukkan
keefektifan pertumbuhan bakteri yang dipengaruhi oleh faktor-faktor lingkungan,
antara lain nutrien, tekanan osmotik, suhu, pH, dan kadar air. Nutrien yang
penting bagi bakteri berupa zat organik (C, H, O, N, Na, K, dan lain
sebagainya) yang akan menjadi sumber energi dan menyediakan unsur-unsur kimia
dasar untuk pertumbuhan (Faridz et al.,
2007). Efek tekanan osmotik berhubungan dengan jumlah ion dan molekul terlarut
di dalam larutan. Konsentrasi garam atau gula yang tinggi menyebabkan air
keluar dari sel bakteri sehingga menghambat pertumbuhan atau menyebabkan
plasmolisis. Sedangkan suhu merupakan faktor fisik yang berpengaruh pada laju
pertumbuhan melalui pengaruhnya di antaranya terhadap reaksi kimia dan stabilitas
struktur molekul protein atau enzim. Suhu optimal bagi E. coli adalah 37 °C (Arivo dan Annissatussholeha, 2017). Selain
suhu, pH juga berpengaruh terhadap efektivitas enzim di mana baik pada pH
rendah maupun tinggi dapat menyebabkan denaturasi enzim. Penurunan aktivitas
enzim akan berdampak pada penurunan jumlah pertumbuhan bakteri. Menurut
Sulistitoningrum et al., dalam Arivo
dan Annissatussholeha (2017), bakteri E.
coli dapat tumbuh optimum pada pH 6–7 dan dapat hidup pada kisaran pH
4,4–9. Adapun air dibutuhkan oleh bakteri untuk menjalankan fungsi
metaboliknya. Kadar air minimun untuk pertumbuhan E. coli adalah 0,96 (Faridz et
al., 2009). Kekurangan atau kelebihan pada salah satu faktor tersebut dapat
menghambat pertumbuhan bakteri sehingga menurunkan laju pertumbuhan.
Arivo,
D. & Annissatussholeha, N., 2017. Pengaruh Tekanan Osmotik pH, dan Suhu terhadap
Pertumbuhan Bakteri Escherichia coli.
Jurnal Ilmu Kedokteran Dan Kesehatan, 4(3),
pp.153-160.
Conrad,
T.M., Frazier, M., Joyce, A.R., Cho, B.K., Knight, E.M., Lewis, N.E., Landick,
R., & Palsson, B.Ø., 2010. RNA Polymerase Mutants Found through Adaptive
Evolution Reprogram Escherichia coli
for Optimal Growth in Minimal Media. Proceedings
of the National Academy of Sciences, 107(47), pp.20500-20505.
Eevers,
N., Gielen, M., Sánchez‐López, A., Jaspers, S., White, J.C., Vangronsveld, J.,
& Weyens, N., 2015. Optimization of Isolation and Cultivation of Bacterial
Endophytes through Addition of Plant Extract to Nutrient Media. Microbial Biotechnology, 8(4),
pp.707-715.
Faridz,
R., Hafiluddin, & Anshari, M., 2007. Analisis Jumlah Bakteri dan Keberadaan
Escherichia coli pada Pengolahan Ikan
Teri Nasi di PT. Kelola Mina Laut Unit Sumenap. Jurnal Embryo, 4(2), pp.94-106.
Habib,
I. & Aminudin, M., 2009. Pengaruh Lamanya Penyimpanan terhadap Pertumbuhan
Bakteri pada Nasi yang Dimasak di Rice
Cooker dengan Nasi yang Dikukus. Mutiara
Medika: Jurnal Kedokteran dan Kesehatan, 9(2), pp.18-22.
Hariati,
S., Wahjuningrum, D., Yuhana, M., Tarman, K., Effendi, I., & Saputra, F.,
2018. Aktivitas Antibakteri Ekstrak Kapang Laut Nodulisporium sp. KT29 terhadap Vibrio
harveyi. Jurnal Pengolahan Hasil Perikanan Indonesia, 21(2), pp.250-257.
Hogg,
S., 2005. Essential Microbiology.
John Wiley and Sons, Inc., Chichester.
Murwani,
S., 2015. Dasar-Dasar Mikrobiologi
Veteriner. Universitas Brawijaya Press, Malang.
Nakajima,
T., Kurita, H., Yasuda, H., Takashima, K., & Mizuno, A., 2012. The Relation
of E. coli Growth Phase and
Low-Temperature He Plasma Jet Exposure. International
Journal of Plasma Enviromental Science & Technology, 6(2), pp.189-193.
Paliy,
O. and Gunasekera, T.S., 2007. Growth of E.
coli BL21 in Minimal Media with Different Gluconeogenic Carbon Sources and
Salt Contents. Applied Microbiology and
Biotechnology, 73(5), pp.1169-1172.
Setyati,
W.A., Martani, E., Triyanto, T., & Zainuddin, M., 2015. Kinetika
Pertumbuhan dan Aktivitas Protease Isolat 36k Berasal dari Sedimen Ekosistem
Mangrove, Karimunjawa, Jepara. ILMU
KELAUTAN: Indonesian Journal of Marine Sciences, 20(3), pp.163-169.
Supriatin,
Y. & Rahayyu, M., 2016. Modification of Carry-Blair Transport Media for
Storage Salmonella typhi. Jurnal Teknologi Laboratorium, 5(2),
pp.72-73.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)













0 Comment:
Post a Comment