BAB IPENDAHULUAN
1.1 Latar Belakang Lipid adalah salah satu kelas molekul biologis berukuran besar yang tidak mencakup polimer sejati, dan biasanya tidak cukup besar untuk dianggap sebagai makromolekul. Senyawa-senyawa yang disebut lipid dikelompokkan menjadi satu karena memiliki satu kesamaan ciri penting, yakni sulit tercampur dengan air, bahkan mungkin tidak bisa sama sekali. Perilaku hidrofobik ini disebabkan oleh struktur molekulnya. Salah satu tipe lipid yang paling penting secara biologis adalah lemak (Campbell dkk., 2010).
Lemak merupakan ester dari asam lemak dan gliserol. Adapun minyak merupakan lemak dalam bentuk cair (Murray dkk., 2009). Pada pembuatan lemak, tiga molekul asal lemak masing-masing menggabungkan diri dengan gliserol melalui tautan ester, ikatan antara gugus hidroksil dan gugus karboksil. Dengan demikian, lemak yang dihasilkan berupa triasilgliserol (trigliserida), terdiri dari tiga asam lemak yang tertaut pada satu molekul gliserol (Campbell dkk., 2010). Sebagian lemak alami seperti yang ada pada minyak nabati, produk susu dan lemak hewani, merupakan gabungan kompleks dari triasilgliserol sederhana maupun campuran. Lemak-lemak tersebut mengandung berbagai asam lemak yang panjang rantai dan tingkat kejenuhannya berbeda (Nelson dan Cox, 2017).
Berdasarkan penjelasan mengenai lipid dan trigliserida sebagai kelompok senyawa organik penting bagi organisme, dilakukan percobaan ini untuk mengidentifikasi gliserol dalam lemak serta reaksi-reaksi trigliserida.
1.2 Maksud dan Tujuan Percobaan
1.2.1 Maksud
Maksud dari percobaan ini adalah untuk mengidentifikasi gliserol yang terdapat dalam suatu sampel dengan menggunakan tes akrolein dan tes kolorimetri.
1.2.2 Tujuan
Tujuan dari percobaan adalah sebagai berikut:
- Mengetahui adanya gliserol pada beberapa sampel melalui tes akrolein
- Mengetahui adanya gliserol pada beberapa sampel melalui tes kolorimetri.
1.3 Prinsip
1.3.1 Tes Akrolein
Mengidentifikasi keberadaan gliserol pada beberapa sampel dengan penambahan KHSO4 lalu dipanaskan hingga timbul bau yang khas yaitu bau karakteristik yang menandakan sampel mengandung gliserol.
1.3.2 Tes Kolorimetri
Mengidentifikasi keberadaan gliserol pada beberapa sampel dengan menambahkan pereaksi tertentu dan dipanaskan hingga terbentuk warna hijau zamrud yang menandakan sampel mengandung gliserol.
BAB IITINJAUAN PUSTAKA
2.1 Lipid
Lipid adalah kelas senyawa yang dibedakan oleh ketidakmampuannya untuk larut dalam air, namun larut dalam pelarut nonpolar (Walker dan McMahon, 2008). Ketika lipid bersentuhan dengan air, secara spontan lipid akan berkumpul untuk membentuk struktur tertentu sehingga bagian hidrofobik dari molekul dikemas bersama-sama menjauh dari air (Berg dkk., 2002). Oleh karena bersifat hidrofobik, lipid penting dalam sistem biologis karena mereka membentuk membran sel, yakni penghalang mekanik yang membagi sel dari lingkungan luar. Lipid juga menyediakan energi untuk kehidupan dan beberapa vitamin penting adalah lipid (Walker dan McMahon, 2008).
Keragaman fungsi dari lipid disebabkan karena adanya variasi yang sangat besar pada struktur dari molekul lipid. Tidak seperti gen dan protein yang hanya disusun oleh kombinasi linear dari 4 asam nukleat dan 20 asam amino, struktur dari lipid umumnya lebih kompleks akibat transformasi biokimia berbeda yang timbul selama biosintesisnya (Fahy dkk., 2011). Lipid ada yang bersifat polar dan nonpolar, tergantung pada strukturnya. Lipid yang menyusun membran merupakan lipid yang bersifat polar. Adapun golongan nonpolar contohnya adalah trigliserida yang berperan sebagai cadangan energi (Walker dan McMahon, 2008).
Lipid diklasifikasikan atas 3 kelompok, yakni (Murray dkk., 2009).
- Lipid sederhana, berupa ester dari asam lemak dengan berbagai macam alkohol. Contohnya adalah lemak, yakni ester dari asam lemak dan gliserol, serta lilin yang merupakan ester dari asam lemak dan monohidrasi alkohol dengan berat molekul lebih tinggi.
- Lipid kompleks, berupa ester dari asam lemak mengandung gugus selain alkohol. Contohnya fosfolipid, glikolipid, sulfolipid, lipoprotein, dan lain sebagainya.
- Prekursor dan derivat lipid, meliputi asam lemak, gliserol, steroid, alkohol, asam aldehid, hidrokarbon, vitamin larut dalam lemak, dan hormon.
2.2 Lemak
Lemak merupakan molekul besar yang tersusun dari sejumlah molekul yang lebih kecil melalui reaksi dehidrasi. Lemak (fat) terbuat dari dua jenis molekul yang lebih kecil, yakni gliserol dan asam lemak. Gliserol merupakan alkohol dengan tiga karbon yang masing-masing berikatan dengan suatu gugus hidroksil. Asam lemak (fatty acid) memiliki rangka karbon panjang, biasanya sepanjang 16 sampai 18 atom karbon. Pada gugus karboksil melekat rantai hidrokarbon yang panjang. Ikatan C-H yang relatif nonpolar dalam rantai hidrokarbon asam lemak merupakan penyebab lemak bersifat hidrofobik (Campbell dkk., 2010).
Terdapat asam lemak jenuh (saturated fatty acid) dan asam lemak tidak jenuh (unsaturatte fatty acid) (Murray dkk., 2009). Jika tidak ada ikatan rangkap di antara atom-atom karbon yang menyusun rantai, maka atom hidrogen dapat terikat sebanyak mungkin pada rangka karbon. Kondisi ini disebut sebagai struktur yang jenuh dengan hidrogen, sehingga asam lemak yang dihasilkan disebut asam lemak jenuh (Campbell dkk., 2010). Asam lemak jenuh bersifat padat pada suhu ruang. Lemak hewani adalah sumber dari asam lemak jenuh (Walker dan McMahon, 2008). Sedangkan asam lemak tak jenuh memiliki satu atau lebih ikatan rangkap, terbentuk dari pelepasan atom-atom hidrogen dari rangka karbon (Campbell dkk., 2010). Asam lemak tak jenuh bersifat cair pada suhu ruang. Gaya intermolekuler antar molekul asam lemak tak jenuh rendah, sehingga molekul-molekulnya mudah untuk dipisahkan dengan cara menaikkan suhu. Tumbuhan merupakan sumber dari asam lemak tak jenuh (Walker dan McMahon, 2008).
2.3 Gliserol
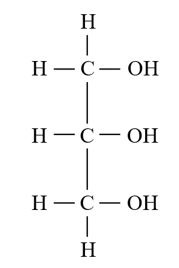
Gambar 2.1 Struktur gliserol (Campbell dkk., 2010)
Gliserol, dengan rumus struktur C3H8O3, merupakan senyawa golongan alkohol polihidrat dengan tiga buah gugus hidroksil dalam satu molekul, bersifat polar dan kental (viscous) (Wahyuni dkk., 2016). Gliserol berwujud cairan jernih, higroskopis, kental, terasa manis namun bersifat racun dan tidak berwarna dengan titik didih 290 °C. Titik didih tinggi yang dimiliki oleh senyawa dengan bobot molekul 92,09 g/mol ini disebabkan adanya ikatan hidrogen yang sangat kuat antar molekul gliserol. Untuk pemurnian gliserol jenis pelarut dan adsorben yang digunakan bermacam-macam. Beberapa pelarut yang sering dipakai yaitu asam klorida (HCl), asam fosfat (H3PO4) dan asam sulfat (H2SO4) (Yurida dkk., 2011).
Konversi gliserol biasanya dilakukan dengan cara esterifikasi, oksidasi dan reduksi gliserol. Proses esterifikasi gliserol yaitu mereaksikan gliserol dengan asam organik maupun asam anorganik yang akan menghasilkan gliserol ester. Dari golongan asam organik misalnya dari kelompok asam karboksilat bisa dihasilkan gliserol asetat, gliserol benzoat, gliserol karbonat dan sebagainya. Proses eterifikasi gliserol yaitu mereaksikan gliserol dengan aryl/alkyl alcohol, dihasilkan gliserol eter. Proses oksidasi gliserol dilakukan untuk mendapatkan produk yang mengandung asam glikolat, asam oksalat dan asam formiat (Abdurrakhman dkk., 2013).
2.4 Tes Akrolein dan Kolorimetri
Uji kualitatif gliserol dapat dilakukan menggunakan metode akrolein. Ketika lemak mengandung gliserol dipanaskan bersama kalium hidrogen sulfat, gliserol akan terdehidrasi, membentuk akrolein yang memiliki bau tengik. Pemanasan lebih lanjut menghasilkan polimerasi akrolein, ditandai dengan menghitamnya larutan. Bau tengik dan warna hitam yang dihasilkan mengindikasikan kehadiran gliserol dalam larutan (Bettelheim dan Landesberg, 2006).
Sedangkan uji kuantitatif gliserol maupun semua sterol dengan gugus 3-β-hidroksil dan ikatan rangkap (posisi 4-5 dan 5-6) dapat dilakukan menggunakan metode kolorimetri. Gliserol dapat dioksidasi membentuk formaldehid. Reagen yang digunakan dalam metode kolorimetri mengandung anhidrida asetat, asam sulfur dan asam glasial asetat. Kadar reagen dan air tertentu akan memberikan warna hijau (Holme dan Peck, 1998). Warna ini disebabkan karena adanya kondisi jenuh dan gugus –OH dari gliserol. Perubahan warna terjadi secara bertahap, yakni pertama-tama muncul sebagai warna merah jambu, berubah menjadi ungu hingga akhirnya menjadi warna hijau tua (Bettelheim dan Landesberg, 2006).
BAB III
METODOLOGI PERCOBAAN
3.1 Bahan Percobaan
Bahan yang digunakan dalam percobaan ini adalah akuades, lilin, mentega, gliserol, minyak sawit, minyak wijen, minyak kelapa, aluminium foil, KHSO4, NaOCl, HCl pekat, α-naftol, dan H2SO4 pekat.
3.2 Alat Percobaan
Alat yang digunakan dalam percobaan ini adalah tabung reaksi, rak tabung, tabung reaksi, rak tabung reaksi, penjepit tabung reaksi, pipet tetes, pipet ukur, gelas kimia 500 mL, spatula, hotplate, dan mesin vortex.
3.3 Prosedur Kerja
3.3.1 Tes Akrolein
Tujuh buah tabung reaksi yang bersih dan steril disiapkan dan diberi label. Masing-masing tabung reaksi dimasukkan 1 mL larutan contoh (akuades, lilin, mentega, minyak sawit, minyak wijen, minyak kelapa dan gliserol). Kemudian ditambahkan +0,5 gram KHSO4 ke dalam masing-masing larutan dan ditutup menggunakan aluminium foil. Setelah itu, dipanaskan dengan hotplate. Timbulnya bau yang khas atau tengik pada larutan menandakan adanya kandungan gliserol.
3.3.2 Tes Kolorimetri
Tujuh buah tabung reaksi yang bersih dan steril disiapkan dan diberi label. Masing-masing tabung reaksi dimasukkan 1 mL larutan contoh (akuades, lilin, mentega, minyak sawit, minyak wijen, minyak kelapa, dan gliserol). Kemudian masing-masing ditambahkan 1 mL NaOCL dan dihomogenkan menggunakan vortex. Ditambahkan 4 tetes HCl pekat dan dihomogenkan kembali. Larutan lalu didiamkan selama +3 menit. Selanjutnya ditambahkan masing-masing 0,2 mL α-naftol dan dihomogenkan. Pada masing-masing tabung lalu ditambahkan 1 mL H2SO4 dan dihomogenkan. Penambahan H2SO4 dilakukan sebanyak 3 kali pengulangan. Perubahan warna menjadi hijau zamrud pada larutan menandakan adanya kandungan gliserol.
BAB IVHASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan
4.1.1 Tes Akrolein
Tabel 1. Hasil Tes Akrolein
No. | Larutan | Setelah Pemanasan |
1. | Gliserol | ++++++ |
2. | Minyak wijen | +++++ |
3. | Minyak sawit | ++++ |
4. | Minyak kelapa | +++ |
5. | Mentega | ++ |
6. | Lilin | + |
7. | Akuades | - |
Keterangan:
++++++ = Luar biasa tengik+++++ = Amat sangat tengik++++ = Sangat tengik+++ = Tengik++ = Lumayan tengik+ = Agak tengik- = Tidak tengik
4.1.2 Tes Kolorimetri
Tabel 2. Hasil Tes Kolorimetri
|
Larutan |
Warna
yang terbentuk |
Fase
yang terbentuk |
|
Akuades |
Hijau kekuningan |
1 fase |
|
Lilin |
Hijau kekuningan |
1 fase |
|
Gliserol |
Hijau zamrud tua |
1 fase |
|
Mentega |
Hijau zamrud tua |
2 fase |
|
Minyak sawit |
Hijau zamrud tua |
2 fase |
|
Minyak wijen |
Hijau zamrud tua |
3 fase |
|
Minyak kelapa |
Hijau zamrud tua |
2 fase |
4.2.1 Tes Akrolein
1. Minyak


2. Lilin

3. Gliserol

4. Mentega

4.2.2 Tes Kolorimetri
1. Minyak



2. Lilin

3. Gliserol


4. Mentega


4.3 Pembahasan
4.3.1 Tes Akrolein
Percobaan ini dilakukan untuk mengidentifikasi gliserol dan mengetahui reaksi-reaksi trigliserida menggunakan metode akrolein. Dalam percobaan, 7 jenis larutan (akuades, lilin, mentega, minyak sawit, minyak wijen, minyak kelapa dan gliserol) masing-masing direaksikan dengan + 0,5 gram KHSO4, yang berfungsi sebagai katalisator pembentukan gliserol pada sampel, di dalam tabung reaksi. Tabung reaksi ditutup menggunakan aluminium foil sebelum dipanaskan dengan hotplate. Tujuan pemanasan adalah agar terjadi proses hidrasi pada sampel sehingga H2O hilang dan akan terbentuk akrolein yang memiliki bau khas, yakni bau yang tajam seperti lemak yang terbakar (bau tengik).
Berdasarkan hasil pengamatan pada masing-masing tabung diperoleh urutan larutan dari yang berbau sampai yang tidak berbau berturut-turut yaitu gliserol, minyak wijen, minyak sawit, minyak kelapa, mentega, lilin dan yang terakhir adalah akuades yang tidak menimbulkan bau. Adanya bau khas menunjukkan bahwa dalam larutan contoh minyak wijen, minyak sawit, minyak kelapa, mentega dan lilin terkandung gliserol. Berdasarkan teori, minyak wijen, minyak sawit, minyak kelapa dan mentega termasuk dalam golongan lipid sederhana, yakni lemak. Lemak merupakan ester dari asam lemak dan gliserol. Sementara itu, lilin merupakan ester dari asam lemak dan alkohol. Dengan demikian, terdapat penyimpangan dari hasil percobaan yang dilakukan dengan teori. Hal tersebut dapat disebabkan karena kontaminasi lilin oleh lemak dari salah satu larutan lainnya.
4.3.2 Tes Kolorimetri
Percobaan ini dilakukan untuk mengidentifikasi gliserol dan mengetahui reaksi-reaksi trigliserida menggunakan metode kolorimetri. Dalam percobaan, 7 jenis larutan (akuades, lilin, mentega, minyak sawit, minyak wijen, minyak kelapa dan gliserol) masing-masing dimasukkan ke dalam tabung reaksi. Ketujuh larutan contoh direaksikan dengan NaOCL, HCl pekat, α-naftol dan H2SO4. Setiap penambahan senyawa diselingi dengan penghomogenan larutan menggunakan vortex. Penambahan HCl berperan sebagai katalisator untuk membentuk gliserol. Untuk mengidentifikasi apakah telah terbentuk gliserol, ditambahkan α-naftol sebagai bahan indikator yang akan memberi warna hijau zamrud. Adapun untuk larutan H2SO4, dilakukan penambahan sebanyak 3 kali pengulangan. Gugus –OH pada α-naftol akan mengalami pemutusan ikatan akibat penambahan H2SO4, sehingga gliserol akan saling berikatan dan memberikan warna hijau zamrud.
Hasil percobaan menunjukkan bahwa untuk akuades dan lilin, warna yang timbul adalah hijau kekuningan dan hanya terbentuk 1 fase. Warna yang terbentuk dapat disebabkan oleh warna salah satu reagen karena berdasarkan teori, akuades tidak tergolong dalam senyawa lipid sementara lilin merupakan ester dari asam lemak dan monohidrasi alkohol dengan berat molekul lebih tinggi. Untuk gliserol, didapatkan warna hijau zamrud tua dengan jumlah fase yang terbentuk adalah satu, menandakan bahwa larutan hanya mengandung gliserol. Sedangkan untuk mentega, minyak kelapa, minyak sawit dan minyak wijen, didapatkan warna yang sama dengan gliserol, menunjukkan bahwa larutan mengandung gliserol. Berdasarkan teori, mentega, minyak kelapa, minyak sawit dan minyak wijen mengandung lemak sehingga ketika dihidrolisis, maka akan membentuk 2 fase, yakni asam lemak dan gliserol. Adapun dalam percobaan, didapatkan warna hijau zamrud tua diakibatkan oleh penambahan H2SO4 yang terlalu banyak.
BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan dari percobaan yang telah dilakukan adalah sebagai berikut:
- Sampel yang mengandung gliserol berdasarkan tes akrolein adalah larutan gliserol, minyak wijen, minyak sawit, minyak kelapa, mentega, lilin, ditandai dengan timbulnya bau tengik. Namun terjadi penyimpangan pada lilin yang berdasarkan teori tidak mengandung gliserol.
- Sampel yang mengandung gliserol berdasarkan tes kolorimetri adalah gliserol, mentega, minyak kelapa, minyak sawit, dan minyak wijen yang ditandai dengan timbulnya warna hijau zamrud tua.
5.2 Saran
5.2.1 Saran untuk Praktikan
Sebaiknya kadar penambahan reagen dapat lebih diperhatikan agar mendapatkan hasil yang baik.
5.2.2 Saran untuk Laboratorium
Sebaiknya diusahakan agar praktikan dapat melakukan kedua prosedur, yakni tes akrolein maupun kolorimetri, agar praktikan dapat memahami setiap prosedur dengan baik.
DAFTAR PUSTAKA
Abdurrakhman, Rifianto,
Y. dan Widayat, 2013, Studi Awal Proses Pembuatan Glycerol Tribenzoat dari
Gliserol dan Asam Benzoat dengan Menggunakan Katalis Asam Klorida, Jurnal Teknologi Kimia dan Industri, 2(3): 30-36.
Berg, J.M.,
Tymoczko, J.L. dan Stryer, L., 2002, Biochemistry,
5th Edition, W.H. Freeman,
New York.
Bettelheim, B.
dan Landesberg, H.H., 2006, Laboratory
Experiments for General, Organic and Biochemistry, 4th Edition, Harcourt College Publisher, New York.
Campbell, N.A.,
Reece, J.B., Urry, L.A., Cain, M.L., Wasserman, S.A., Minorsky, P.V. dan
Jackson, R.B., 2010, Biologi, Jilid
1, Edisi 8, Terjemahan oleh Damaring Tyas Wulandari, Erlangga, Jakarta.
Fahy, E., Cotter,
D., Sud, M. dan Subramaniam, S., 2011, Lipid Classification, Structures and
Tools, Biochim Biophys Acta, 1811(11): 637-647.
Holme, J.D. dan
Peck, H., 1998, Analytical Biochemistry,
3rd Edition, Prentice Hall, Edinburg.
Mathews, C.K.,
Holde, K.E.V. dan Ahern, K.G., 2000, Biochemistry,
3rd Edition, Benjamin Cummings, San Fransisco.
Maulinda, L.,
Nasrul, Z.A. dan Nurbaiti, 2016, Hidrolisis Asam Lemak dari Buah Sawit Sisa
Sortiran, Jurnal Teknologi Kimia Unimal,
5(11): 1-16.
Murray, R.K.,
Bender, D.A., Botham, K.M., Kennelly, P.J., Rodwell, V.W. dan Weil, P.A., 2009,
Harper’s Illustrated Biochemistry, 28th
Edition, The McGraw-Hill Companies, Inc., New York.
Nelson, D.L. dan
Cox, M.M., 2017, Lehninger Principles of
Biochemistry: International Edition, 7th Edition, W.H. Freeman,
New York.
Wahyuni, S.,
Hambali, E. dan Marbun, B.T.H., 2016, Esterifikasi Gliserol dan Asam Lemak
Jenuh Sawit dengan Katalis Mesa, Jurnal
Teknologi Industri Pertanian, 26(3):
333-342.
Walker, S. dan
McMahon, D., 2008, Biochemistry
Demystified: A Self-Teaching Guide, The McGraw-Hill Companies, Inc., New
York.
Yurida, M., Afriani.
E. dan Arita, S., 2013, Pengaruh Kandungan CaO dari Jenis Adsorben Semen
terhadap Kemurnian Gliserol, Jurnal
Teknik Kimia, 19(2): 33-42.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)
















0 Comment:
Post a Comment