BAB IPENDAHULUAN
1.1 Latar Belakang
Reaksi-reaksi kimia mengubah subtansi yang telah diketahui dengan baik menjadi subtansi lain yang memiliki properti berbeda. Hasil dari reaksi kompleks dapat dilihat dari adanya perubahan warna dari reaktan dan produk. Dalam hal ini, reaksi multi-redoks timbul, dengan produk dari salah satu reaksi menjadi reaktan dari reaktan lain. Laju pada saat timbulnya reaksi disebut dengan kecepatan reaksi atau laju reaksi (Brown, dkk., 2012).
Untuk mengetahui bagaimana suatu reaksi terjadi, maka diuji laju reaksi dan faktor-faktor yang mempengaruhinya. Informasi ekperimental dari laju sebuah reaksi yang diberikan memberikan bukti-bukti penting yang membantu kita mengformulasikan suatu mekanisme reaksi, langkah demi selangkah, pandangan level molekul dari reaktan menjadi produk (Brown, dkk., 2012).
Digunakan suatu metode untuk mempercepat suatu reaksi. Metode itu adalah menaikkan suhu, sifat pereaksi, konsentrasi suatu zat, luas permukaan dan lain sebagainya. Jika metode-metode suatu reaksi tersebut tidak pula berjalan dengan cepat maka kita harus menambahkan suatu zat yang dapat mempercepat suatu reaksi dimana zat tersebut tidak bereaksi dengan zat pada reaktan, atau dapat dikatakan mempercepat suatu reaksi tanpa ikut bereaksi. Zat itu dikenal dengan nama katalis.
Berdasarkan uraian di atas, maka perlu dilakukan percobaan untuk mengetahui bagaimana konsentrasi dan suhu memberikan pengaruh pada kecepatan reaksi.
1.2 Maksud dan Tujuan Percobaan
1.2.1 Maksud
Maksud dari percobaan adalah untuk memberikan pemahaman kepada praktikan mengenai pengaruh konsentrasi dan suhu pada kecepatan reaksi.
1.2.1 Tujuan
Tujuan dari percobaan adalah sebagai berikut:
- Mengetahui pengaruh konsentrasi terhadap kecepatan reaksi
- Mengetahui pengaruh suhu terhadap kecepatan reaksi
1.3 Prinsip
Adapun prinsip dari percobaan adalah mereaksikan larutan H2SO4 dengan Na2S2O3 yang memiliki konsentrasi serta suhu yang berbeda dan telah diencerkan.
BAB IITINJAUAN PUSTAKA
2.1 Kecepatan Reaksi
Lingkup dari kimia berkaitan dengan kecepatan atau laju ketika timbulnya reaksi kimia yang disebut dengan kimia kinetik. Kata ‘kinetik’ berarti perpidahan atau perubahan. Kinetik yang dimaksudkan adalah merujuk pada kecepatan dari suatu reaksi atau laju reaksi, di mana perubahan konsentrasi dari suatu reaktan atau produk terhadap waktu (m/s) (Chang, 2008).
Reaksi-reaksi kimia mengubah subtansi yang telah diketahui dengan baik menjadi subtansi lain yang memiliki properti berbeda. Hasil dari reaksi kompleks dapat dilihat dari adanya perubahan warna dari reaktan dan produk. Dalam hal ini, reaksi multi-redoks timbul, dengan produk dari salah satu reaksi menjadi reaktan dari reaktan lain. Laju pada saat timbulnya reaksi disebut dengan kecepatan reaksi atau laju reaksi. Untuk mengetahui bagaimana suatu reaksi terjadi, maka diuji laju reaksi dan faktor-faktor yang mempengaruhinya. Informasi ekperimental dari laju sebuah reaksi yang diberikan memberikan bukti-bukti penting yang membantu kita mengformulasikan suatu mekanisme reaksi, langkah demi selangkah, pandangan level molekul dari reaktan menjadi produk (Brown, dkk., 2012).
Salah satu cara untuk memahami pengaruh konsentrasi reaktan pada kecepatan reaksi adalah dengan menentukan bagaimana kecepatan awal reaksi bergantung pada konsentrasi awal. Secara umum, itu lebih baik untuk mengukur kecepatan awal karena saat reaksi berlangsung, konsentrasi reaktan menurun dan mungkin menjadi sulit untuk mengukur perubahan secara akurat (Chang, 2008).
Adapun orde suatu reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju bentuk differensial. Pada umumnya orde reaksi merupakan bilangan bulat dan kecil, namun dalam beberapa hal dapat berupa bilangan pecahan atau nol (Petrucci, 1987).
Orde reaksi terhadap suatu zat tertentu tidak sama dengan koefisien dalam persamaan stoikiometri reaksi. Harga n memberikan orde reaksi jika n=0, maka laju reaksinya disebut orde nol terhadap X. Hal ini berarti bahwa perubahan konsentrasi X tidak berpengaruh pada laju reaksi (Petrucci, 1987).
2.2 Faktor-Faktor yang Memengaruhi Kecepatan Reaksi
Pada umumnya nilai konstanta kecepatan reaksi dipengaruhi oleh faktor tumbukan, energi aktivasi, dan suhu reaksi (Sylvia, dkk., 2015). Adapun menurut Brown, dkk. (2012), terdapat empat faktor yang dapat menyebabkan perubahan kecepatan reaksi, sebagai berikut:
1. Keadaan Fisik Reaktan
Semakin siap molekul-molekul reaktan bertumbukan satu sama lain, maka semakin cepat bereaksi. Sebagian besar reaksi yang kami anggap homogen, melibatkan semua gas maupun zat cair. Dengan demikian, reaksi-reaksi heterogen yang melibatkan zat padat cenderung berproses lebih cepat jika area permukaan dari padatan meningkat. Sebagai contoh, sebuah obat dalam bentuk bubuk larut dalam perut dan memasuki darah lebih cepat daripada obat yang sama dalam bentuk tablet.
2. Konsentrasi Reaktan
Sebagian besar reaksi kimia berproses lebih cepat jika konsentrasi dari satu atau lebih reaktan meningkat. Sebagai contoh, wol baja terbakar hanya dengan lambat jika di dalam air, yang mengandung O2, namun terbakar dengan cepat dalam oksigen murni. Seiring dengan meningkatnya konsentrasi reaktan, frekuensi terjadinya tumbukan pada molekul reaktan akan meningkat, maka laju reaksi pun juga meningkat.
3. Temperatur Reaksi
Kecepatan reaksi secara umum meningkat seiring dengan meningkatnya suhu. Reaksi bakteri yang merusak susu, contohnya, berproses lebih cepat dalam suhu ruangan dibanding pada suhu yang lebih rendah dari kulkas. Temperatur yang meningkat meningkatkan energi-energi kinetik dari molekul. Meningkatnya kecepatan molekul akan meningkatkan frekuensi tumbukan molekul dengen energi yang lebih tinggi, sehingga kecepatan reaksi pun semakin meningkat pula. Semakin tinggi temperatur, maka konstanta kecepatan reaksinya juga semakin cepat atau konstanta laju reaksi berbanding lurus dengan temperatur (Anjana, dkk., 2014).
Pengaruh suhu terhadap kecepatan reaksi dapat dilihat dari eksperimen reaksi asam gel dengan kalsit pada suhu berbeda. Reaksi meningkat secara signifikan seiring suhu meningkat dari 30 °C sampai 70 °C. Tingkat reaksi asam gel dan kalsit pada temperatur 70 °C kira-kira adalah dua kali lipat laju reaksi pada temperatur 30°C.
4. Kehadiran dari Suatu Katalis
Agen katalis dapat mempercepat reaksi tanpa mengurangi jumlah katalis itu sendiri. Katalis memberikan efek pada jenis tumbukan sehingga terjadi reaksi. Katalis memiliki banyak peran penting bagi kehidupan organisme, termasuk diri kita sendiri.
BAB IIIMETODOLOGI PERCOBAAN
3.1 Bahan Percobaan
Bahan-bahan yang digunakan dalam percobaan adalah larutan H2SO4, Na2S2O3, akuades, dan tisu gulung.
3.2 Alat Percobaan
Alat-alat yang digunakan dalam percobaan adalah tabung reaksi, stopwatch, kaki tiga, rak tabung, gelas piala, kawat kasa, dan lampu spiritus.
3.3 Prosedur Kerja
3.3.1 Pengaruh Konsentrasi terhadap Kecepatan Reaksi
Disediakan lima buah tabung reaksi dan masing-masing diisi dengan 5 mL H2SO4 0,1 M (H2SO4 tetap). Lima buah tabung reaksi lain diisi dengan 5 mL, 4 mL, 3 mL, 2 mL, dan 1 mL Na2S2O3 0,1 M dan diencerkan dengan akuades hingga mencapai volume 5 mL. Dicampurkan isi tabung reaksi tersebut dari 5 sediaan pertama ke dalam masing-masing sediaan kedua dan bersamaan dengan bercampurnya kedua zat tersebut, stopwatch dijalankan. Stopwatch dihentikan setelah ada reaksi (keruh), kekeruhan yang berlebihan dihindari. Dicatat waktu yang digunakan dan ditentukan nilai m, k, serta dibuat persamaan kecepatan reaksinya. Dengan cara yang sama, diulangi langkah 1 sampai 5 pada H2SO4 namun pada Na2S2O3 0,1 M konsentrasinya tetap.
3.3.2 Pengaruh Suhu terhadap Kecepatan Reaksi
Dipilih salah satu konsentrasi H2SO4 dan Na2S2O3. Disiapkan 6 buah tabung reaksi, 3 buah diisi dengan Na2S2O3 dan 3 buah lainnya diisi dengan H2SO4. Dimasukkan sepasang tabung reaksi (ad-2) ke dalam gelas piala yang berisi air dingin beberapa menit sehingga suhunya merata termasuk suhu larutannya. Diambil sepasang tabung reaksi dan dicampurkan isi tabung tersebut. Stopwatch dijalankan sementara zat dicampurkan. Stopwatch dihentikan jika telah terjadi reaksi. Dicatat waktu yang digunakan dan suhu reaksi. Langkah 1 sampai 7 dikerjakan kembali pada interval suhu yang berbeda.
BAB IVHASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan
4.1.1 Pengaruh Konsentrasi Na2S2O3
Reaksi berlangsung pada suhu 29 ºC
Kosentrasi Na2S2O3
(M)
|
Kosentrasi H2SO4
(M)
|
Waktu (s)
|
1/waktu (s-1)
|
0,1
|
0,1
|
81 s
|
0,0123
|
0,08
|
0,1
|
67 s
|
0,0149
|
0,06
|
0,1
|
44 s
|
0,0227
|
0,04
|
0,1
|
30 s
|
0,0333
|
0,02
|
0,1
|
23 s
|
0,0434
|
4.1.2 Pengaruh Konsentrasi H2SO4
Reaksi berlangsung pada suhu 29 ºC
Konsentrasi H2SO4
(M)
|
Kosentrasi Na2S2O3
(M)
|
Waktu (s)
|
1/waktu (s-1)
|
0,1
|
0,1
|
40 s
|
0,025
|
0,08
|
0,1
|
35 s
|
0,02
|
0,06
|
0,1
|
39 s
|
0,026
|
0,04
|
0,1
|
29 s
|
0,034
|
0,02
|
0,1
|
25 s
|
0,04
|
4.1.3 Pengaruh Suhu
Reaksi berlangsung pada suhu 29 ºC
Kosentrasi H2SO4
(M)
|
Kosentrasi Na2S2O3
(M)
|
Suhu (ºC)
|
waktu (det)
|
0,1
|
0,1
|
29ºC
|
32,00
|
0,1
|
0,1
|
90ºC
|
10,00
|
0,1
|
0,1
|
15ºC
|
72,00
|
4.2 Reaksi
Na2S2O3 + H2SO4
à
Na2SO4 + H2SO3 + S↓
4.3 Perhitungan
4.3.1 Pengenceran
A. Pengaruh Konsentrasi Na2S2O3
Untuk konsentrasi = 0,1 M
V1M1 = V2M2
5 . 0,1 = 5 . M2
M2 = 0,1 M
Untuk konsentrasi = 0,08 M
V1M1 = V2M2
4 . 0,1 = 5 . M2
M2 = 0,08 M
Untuk konsentrasi = 0,06 M
V1M1 = V2M2
3 . 0,1 = 5 . M2
M2 = 0,06 M
Untuk konsentrasi = 0,04 M
V1M1 = V2M2
2 . 0,1 = 5 . M2
M2 = 0,04 M
Untuk konsentrasi = 0,02 M
V1M1 = V2M2
1 . 0,1 = 5 . M2
M2 = 0,02 M
B. Pengaruh Konsentrasi H2SO4
Untuk konsentrasi = 0,1 M
V1M1 = V2M2
5 . 0,1 = 5 . M2
M2 = 0,1 M
Untuk konsentrasi = 0,08 M
V1M1 = V2M2
4 . 0,1 = 5 . M2
M2 = 0,08 M
Untuk konsentrasi = 0,06 M
V1M1 = V2M2
3 . 0,1 = 5 . M2
M2 = 0,06 M
Untuk konsentrasi = 0,04 M
V1M1 = V2M2
2 . 0,1 = 5 . M2
M2 = 0,04 M
Untuk konsentrasi = 0,02 M
V1M1 = V2M2
1 . 0,1 = 5 . M2
M2 = 0,02 M
4.3.2 Grafik
A. Pengaruh Konsentrasi Na2S2O3
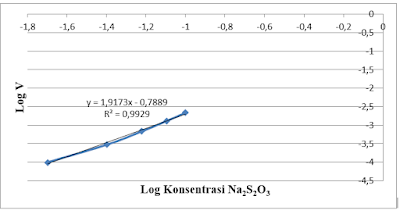
Tabel. 4 Pengaruh Konsentrasi Na2S2O3
No
|
Na2S2O3 awal
|
V
(M/detik)
|
Log Na2S2O3
|
Log V
|
1.
2.
3.
4.
5.
|
0,02
0,04
0,06
0,08
0,1
|
0,000099
0,0002985
0,0006818
0,0013
0,00217
|
-1,69897
-1,3979
-1,2218
-1,0969
-1
|
-4,0043
-3,5250
-3,1663
-2,8860
-2,6635
|
Grafik 1. Pengaruh Konsentrasi Na2S2O3
R2 = 0,992
slope = 1,917
intercept = -0,788
Log Ka = intercept
Log Ka = -0,788
Ka = 0,1629
V1 = Ka [Na2S2O3]1m
0,000099= 0,1629 x [0.02]m
= 0,02m
m = 1,8930
= 0,02m
m = 1,8930
1. a. Log V1 = Log Ka1 + m Log [Na2S2O3]1
-4,0043 = Log Ka1 + 1,8930 x -1.69897
Log Ka1 = -0,78814
Ka1 = 0,16287
b. Log V2 = Log Ka2 + m Log [Na2S2O3]2
b. Log V2 = Log Ka2 + m Log [Na2S2O3]2
-3,5250 = Log Ka2 + 1,8930 x -1,3979
Log Ka2 = -0,8787
Ka2 = 0,13219
c. Log V3 = Log Ka3 + m Log [Na2S2O3]3
-3,1663 = Log Ka3 + 1,8930 x -1,2218
Log Ka3 = -0,8534
Ka3 = 0,1401
d. Log V4 = Log Ka4 + m Log [Na2S2O3]4
-2,886 = Log Ka4 + 1,8930 x -1,0969
Log Ka4 = -0,8095
Log Ka4 = -0,8095
Ka4 = 0,155
e. Log V5 = Log Ka5 + m Log [Na2S2O3]5
-2,6635 = Log Ka5 + 1,8930 x -1
Log Ka5 = -0,7705
Ka5 = 0,1696
2. a. V1 = Ka1 [Na2S2O3]m
V1 = 0,16287 x (0,02)1,8930
V1 = 0,000099 M/detik
b. V2 = Ka2 [Na2S2O3]m
V2 = 0,13219 x (0,04)1,8930
V2 = 0,00029846 M/detik
c. V3 = Ka3 [Na2S2O3]m
V3 = 0,1401 x (0,06)1,8930
V3 = 0,0006815 M/detik
d. V4 = Ka4 [Na2S2O3]m
V4 = 0,155 x (0,08)1,8930
V4 = 0,00129 M/detik
e. V5 = Ka5 [Na2S2O3]m
V5 = 0,1696 x (0,1)1,8930
V5 = 0,002169 M/detik
B. Pengaruh Konsentrasi H2SO4
No
|
H2SO4
awal
|
V
(M/detik)
|
Log H2SO4
|
Log V
|
1.
2.
3.
4.
5.
|
0,02
0,04
0,06
0,08
0,1
|
0,00025
0,0005714
0,001
0,0013793
0,002
|
-1,69897
-1,3979
-1,2218
-1,0969
-1
|
-3,6020
-3,2430
-3
-2,860
-2,6989
|
Grafik 2. Pengaruh Konsentrasi H2SO4
slope = 1,278
intercept = -1,440
Log Ka = intercept
Log Ka = -1,440
Ka = 0,0363
V1 = Ka [H2SO4]1m
intercept = -1,440
Log Ka = intercept
Log Ka = -1,440
Ka = 0,0363
V1 = Ka [H2SO4]1m
0,00025 = 0,0363 x [0.02]m
0,00025/0,0363 = 0,02m
0,00025/0,0363 = 0,02m
m = 1,2725
1. a. Log V1 = Log Ka1 + m Log [H2SO4]1
-3,6020 = Log Ka1 + 1,2725 x -1.69897
Log Ka1 = -1,44
Ka1 = 0,0363
b. Log V2 = Log Ka2 + m Log [H2SO4]2
-3,2430 = Log Ka2 + 1,2725 x -1,3979
Log Ka2 = -1,464
Ka2 = 0,03434
c. Log V3 = Log Ka3 + m Log [H2SO4]3
-3 = Log Ka3 + 1,2725 x -1,2218
Log Ka3 = -1,4452
Ka3 = 0,03587
d. Log V4 = Log Ka4 + m Log [H2SO4]4
-2,860 = Log Ka4 + 1,2725x -1,0969
Log Ka4 = -1,4641
Ka4 = 0,03434
e. Log V5 = Log Ka5 + m Log [H2SO4]5
-2,6989 = Log Ka5 + 1,2725 x -1
Log Ka5 = -1,4264
Ka5 = 0, 03746
2. a. V1 = Ka1 [H2SO4]m
V1 = 0,0363 x (0,02)1,2725
V1 = 0,00025 M/detik
b. V2 = Ka2 [H2SO4]m
V2 = 0,03434 x (0,04)1,2725
V2 = 0,00057137 M/detik
c. V3 = Ka3 [H2SO4]m
V3 = 0,03587 x (0,06)1,2725
V3 = 0,0009 M/detik
d. V4 = Ka4 [H2SO4]m
V4 = 0,03434 x (0,08)1,2725
V4 = 0,00138 M/detik
e. V5 = Ka5 [H2SO4]m
V5 = 0,03746 x (0,1)1,2725
V5 = 0,002 M/detik
No
|
V
(M/detik)
|
T (oC)
|
ln V
|
1/T
|
1.
2.
3.
|
0,000694
0,00156
0,005
|
72
32
10
|
-7,2730
-6,46307
-5,2983
|
0,013889
0,03125
0,1
|
R2 = 0,948
slope = 0,044
intercept = 0,331
Log Ka = intercept
Log Ka = 0,331
Ka = 2,14289
V1 = Ka [H2SO4]1m
intercept = 0,331
Log Ka = intercept
Log Ka = 0,331
Ka = 2,14289
V1 = Ka [H2SO4]1m
0,000694 = 2,14289 x [0.02]m
0,000694/2,14289 = 0,02m
m = 2,05395
0,000694/2,14289 = 0,02m
m = 2,05395
1. a. Log V1 = Log Ka1 + m Log [H2SO4]1
-3,15864 = Log Ka1 + 2,05395 x -1
Log Ka1 = -1,1046
Ka1 = 0,0785
b. Log V2 = Log Ka2 + m Log [H2SO4]2
-2,806 = Log Ka2 + 2,05395 x -1
Log Ka2 = -0,75205
Ka2 = 0,17699
c. Log V3 = Log Ka3 + m Log [H2SO4]3
-2,301 = Log Ka3 + 2,05395 x -1
Log Ka3 = -0,247
Ka3 = 0,56623
2. a. V1 = Ka1 [H2SO4]m
V1 = 0,0785 x (0,1)2,05395
V1 = 0,0006932 M/detik
b. V2 = Ka2 [H2SO4]m
V2 = 0,17699 x (0,1)2,05395
V2 = 0,0015631 M/detik
c. V3 = Ka3 [H2SO4]m
V3 = 0,56623 x (0,1)2,05395
V3 = 0,005 M/detik
4.3 Pembahasan
Pada praktikum kecepatan reaksi ini hanya membahas mengenai pengaruh suhu dan konsentrasi terhadap laju suatu reaksi. Dari data hasil percobaan terlihat jelas bagaimana suhu dan konsentrasi berpengaruh terhadap laju reaksi. Untuk reaksi yang berlangsung dengan konsentrasi salah satu reaktan yang lebih kecil akan berlangsung lebih lambat jika dibandingkan dengan reaksi yang berlangsung dengan konsentrasi salah satu reaktan yang lebih tinggi. Data kecepatan reaksi yang diperoleh untuk Na2S2O3 dengan konsentrasi berturut-turut 0,02 M; 0,04 M; 0,06 M; 0,08 M, dan 0,1 M adalah 0,000099 M/detik; 0,0002985 M/detik; 0,0006818 M/detik; 0,0013 M/detik, dan 0,00217 M/detik. Diperoleh untuk H2SO4 dengan konsentrasi berturut-turut 0,02 M; 0,04 M; 0,06 M; 0,08 M, dan 0,1 M adalah 0,00025 M/detik; 0,0005714 M/detik; 0,001 M/detik; 0,00138 M/detik, dan 0,002 M/detik. Untuk reaksi yang berlangsung dengan pengaruh suhu, suhu yang tinggi reaksinya akan berlangsung lebih cepat jika dibandingkan dengan reaksi yang bersuhu rendah. Data kecepatan reaksi yang diperoleh dari pencampuran H2SO4 danNa2S2O3 dengan suhu yang bervariasi yaitu 72 ºC, 29 ºC, dan 10 ºC yang masing-masing konsentrasinya 0,1 M adalah 0,0006932 M/detik; 0,0015631 M/detik, dan 0,005 M/detik sehingga suhu 72 ºC kecepatan reaksinya lebih cepat.
Walau demikian, terdapat beberapa hal yang mungkin sedikit memengaruhi hasil pengamatan dari praktikum ini, yakni adanya pengocokan yang dilakukan pada saat kedua senyawa dicampurkan. Pengocokan ini akan berpengaruh terhadap waktu yang diperlukan untuk berlangsungnya suatu reaksi dengan kata lain dapat meningkatkan laju reaksi sehingga data hasil percoban yang diperoleh kurang akurat. Pengocokan yang dilakukan akan meningkatkan kinetika dalam larutan sehingga banyak terjadi tumbukan. Banyaknya tumbukan menyebabkan kemungkinan terjadinya reaksi akan lebih besar sehingga waktu yang diperlukan untuk bereaksi menjadi lebih singkat.
BAB VKESIMPULAN DAN SARAN
5.1 KesimpulanAdapun kesimpulan dari percobaan adalah sebagai berikut:
- Konsentrasi dapat mempengaruhi laju suatu reaksi, di mana semakin tinggi konsentrasi suatu zat yang direaksikan maka akan semakin cepat laju reaksi tersebut. Hal tersebut dibuktikan dari data hasil percobaan untuk larutan Na2S2O3 0,02 M yang memiliki kecepatan reaksi 0,000891 M/s dan 0,1 M yang memiliki kecepatan reaksi yakni 0,002169 M/s. Untuk larutan H2SO4 0,02 M memiliki kecepatan reaksi 0,00225 M/s dan untuk 0,1 M memiliki kecepatan reaksi 0,002 M/s.
- Suhu dapat memengaruhi laju suatu reaksi, di mana semakin tinggi suhu maka akan semakin cepat laju reaksi tersebut. Hal tersebut dibuktikan dari data hasil percobaan yang konsentrasinya sama untuk suhu 27 ºC memiliki kecepatan reaksi 0,0006932 M/s, pada suhu 29 ºC memiliki kecepatan reaksi 0,0015631 M/s dan pada suhu 10 ºC memiliki kecepatan reaksi 0,005 M/s.
Dalam melakukan praktikum kecepatan reaksi, sebaiknya tidak hanya menguji pengaruh suhu dan konsentrasi saja, melainkan faktor yang lain juga.
DAFTAR PUSTAKA
Anjana, F., Widya, R.O. dan Roesyadi, A.,
2014, Studi Kinetika Dekomposisi Glukosa pada Temperatur Tinggi, Surabaya, Jurnal Teknik Pomits, 3(2): 122-126.
Brown, T. L., Eugene, L., Bruce, E. B., Catherine,
J.M. dan Patrick, M.W., 2012,Chemistry
the Central Science 12th Edition, Amerika Serikat, Pearson
Prentice Hall.
Sylvia, N., Meriatna dan Haslina, 2015,Kinetika
Hidrolisa Kulit Pisang Kepok Menjadi Glukosa Menggunakan Katalis Asam Klorida, Aceh,
Jurnal Teknologi Kimia Unimal, 4(2): 51-65.
Chang, R., 2008, General Chemistry: The Essential Concepts, Fifth Edition. New York,
McGraw-Hill Higher Education.
Iqbal, S.A. dan Ameera, A.H., 2011,Textbook of Analytical Chemistry, New
Delhi, Tilak Wasan.
Liao, Y., Dezheng,Z., Jianfeng, P., Hao, L. dan Yunlei G., 2017, Measurement
of Reaction Rate of Gelled Acids and Calcite with the Rotating Disk Apparatus, China,
Jurnal of Natural Resources, 8(8):10-20.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)



























0 Comment:
Post a Comment