BAB I PENDAHULUAN
1.1 Latar Belakang
Topik kesetimbangan kimia merupakan bagian esensial dalam kimia, karena mendasari konsep kimia lanjut misalnya kesetimbangan larutan, kesetimbangan fasa dan kesetimbangan reaksi sel elektrokimia (Muti’ah, 2015). Kesetimbangan adalah keadaan di mana tidak ada perubahan yang dapat diamati seiring berjalannya waktu (Chang, 2010). Bila reaksi kimia telah mencapai keadaan setimbang, konsentrasi reaktan dan produk tetap konstan dan tidak ada terlihat perubahan dalam sistem. Reaksi di mana reaktan dikonversi ke produk dan produk dikonversi menjadi reaktan di bejana reaksi yang sama secara alami menyebabkan keadaan setimbang, terlepas dari seberapa rumit reaksinya dan terlepas dari sifat proses kinetik untuk maju dan reaksi balik (Brown, dkk., 2012).
Contoh proses kesetimbangan dapat dirumuskan untuk reaksi-reaksi yang lain, salah satunya adalah kesetimbangan untuk asam dan basa. Kesetimbangan asam basa adalah suatu kesetimbangan yang prinsip-prinsipnya terjadi pada suatu senyawa asam, basa, atau asam dan basa. Asam dan basa yang umumnya mengalami kesetimbangan adalah reaksi asam dan basa lemah. Tetapan kesetimbangan asam dan basa lemah sangat mempengaruhi nilai pH dari suatu larutan.
Oleh karena itu, sangatlah penting untuk mempelajari kesetimbangan asam basa. Karena dengan mempelajari kesetimbangan asam basa, maka dapat ditentukan nilai pH suatu larutan.
1.2 Maksud dan Tujuan Percobaan
1.2.1 Maksud
Maksud dari percobaan adalah untuk mengetahui dan mempelajari cara menentukan pH larutan asam lemah, pengaruh pengenceran terhadap nilai pH, tetapan kesetimbangan dan derajat ionisasi asam lemah berdasarkan nilai pH.
1.2.1 Tujuan
Tujuan dari percobaan adalah sebagai berikut:
- Menentukan pH larutan asam lemah dengan menggunakan kertas pH universal.
- Menentukan pengaruh pengenceran terhadap nilai pH, tetapan kesetimbangan ionisasi dan derajat ionisasi larutan asam lemah.
- Menentukan derajat ionisasi asam lemah berdasarkan nilai pH.
1.3 Prinsip
Prinsip dari percobaan ini adalah menentukan nilai pH larutan asam lemah menggunakan kertas pH universal. Kemudian hasil dari pengukuran pH tersebut digunakan untuk menentukan tetapan kesetimbangan ionisasi dan derajat ionisasi asam lemah. Selanjutnya, dilakukan perhitungan untuk menentukan pengaruh pengenceran terhadap nilai pH, tetapan kesetimbangan ionisasi dan derajat ionisasi larutan asam lemah.
BAB II
TINJAUAN PUSTAKA
2.1 Kesetimbangan Kimia
Kesetimbangan adalah keadaan di mana tidak ada perubahan yang dapat diamati seiring berjalannya waktu. Bila reaksi kimia telah mencapai keadaan setimbang, konsentrasi reaktan dan produk tetap konstan seiring berjalannya waktu, dan tidak ada terlihat perubahan dalam sistem. Namun, ada banyak aktivitas pada molekul karena molekul reaktan terus membentuk molekul produk sementara molekul produk bereaksi terhadap molekul reaktan (Chang, 2010).
Menurut Chang (2008), faktor-faktor yang mempengaruhi kesetimbangan kimia adalah sebagai berikut:
a. Perubahan konsentrasi
Pada keadaan setimbang, semua reaktan dan produk hadir dalam sistem reaksi. Meningkatkan konsentrasi produk akan menyebabkan tergesernya kesetimbangan ke kiri, dan menurunkan konsentrasi dari produk akan menyebabkan tergesernya kesetimbangan ke kanan. Hasil ini sama seperti yang diprediksi oleh prinsip Le Châtelier yang menyatakan bahwa jika tekanan eksternal diterapkan pada sistem kesetimbangan, maka sistem akan menyesuaikan sedemikian rupa sehingga sebagian tegangan diimbangi karena mencoba untuk membangun kembali keadaan setimbang.
b. Perubahan tekanan dan volume
Secara umum, kenaikan tekanan (penurunan volume) sebanding dengan reaksi tetap yang menurunkan total mol gas (reaksi balik), dan penurunan tekanan (kenaikan volume) sebanding dengan reaksi tetap yang meningkatkan jumlah mol gas.
c. Perubahan temperatur
Perubahan konsentrasi, tekanan, atau volume dapat mengubah posisi setimbang, yaitu jumlah reaktan dan produk relatif, namun tidak mengubah nilainya dari konstanta kesetimbangan. Hanya perubahan suhu yang bisa mengubah tetapan setimbang. Suhu meningkatkan arah endotermis dan menurunkan arah eksotermis.
2.2 Reaksi Asam Basa
Dari sudut pandang praktis, asam dapat diidentifikasi dari rasanya yang masam, kemampuannya bereaksi dengan berbagai logam dan mineral karbonat, dan pengaruhnya pada warna zat yang dinamakan indikator asam-basa. Dari pandangan kimiawan, asam dapat didefinisikan sebagai zat yang memberikan ion hidrogen [H+] dalam larutan tersebut. Asam yang tidak mengion sempurna dalam larutan berair disebut asam lemah. Seperti halnya asam asetat, sebagian besar asam adalah asam lemah (Petrucci, 2008).
Adapun dari sudut pandang praktis, kita dapat mengidentifikasikan basa melalui rasanya yang pahit, licin dan pengaruhnya pada warna indikator asam-basa. Definisi Arrhenius tentang basa adalah zat yang menghasilkan ion hidroksida [OH-] dalam larutan berair. NH3 adalah elektrolit lemah sehingga reaksinya dengan air tidak berlangsung sempurna. Basa yang mengion tidak sempurna dalam larutan berair adalah basa lemah. Sebagian besar zat yang bersifat basa adalah basa lemah (Petrucci, 2008).
2.3 Kesetimbangan Asam-Basa
Tetapan kesetimbangan dapat ditulis untuk ionisasi asam lemah dan basa lemah, seperti halnya untuk kesetimbangan reaksi yang lain. Untuk persamaan (Goldberg, 2004):
Meskipun demikian, dalam larutan encer, konsentrasi H2O biasanya tetap dan ikut menentukan nilai tetapan kesetimbangan. Tetapan baru, yang disebut Ka atau Ki untuk asam (Kb atau Ki untuk basa), tidak memiliki konsentrasi air dalam persamaan tetapan kesetimbangannya (Goldberg, 2004):
Nilai tetapan untuk larutan air murni encer pada suhu 25 ºC adalah 1,0 x 10-4. Oleh karena itu, air yang terionisasi sangat kecil jumlahnya ketika berada dalam keadaan murni dan bahkan lebih kecil lagi dalam larutan asam atau larutan basa (Goldberg, 2004).
Skala pH yang dipergunakan demi mengurangi keharusan penggunaan pangkat yang menyatakan sifat keasaman. pH didefinisikan sebagai berikut (Goldberg, 2004):
pH = -log [H3O+]............................................(II.4)
Dari cara pendefinisian pH dan nilai Kw, dapat diperkirakan bahwa larutan dengan pH = 7 bersifat netral, larutan dengan pH kurang dari 7 bersifat asam, dan larutan dengan pH lebih besar dari 7 bersifat basa (Goldberg, 2004).
BAB IIIMETODOLOGI PERCOBAAN
3.1 Bahan Percobaan
Bahan-bahan yang digunakan dalam percobaan adalah asam formiat 0,1 M, asam cuka 0,1 M, akuades, kertas pH universal, dan pH meter.
3.2 Alat Percobaan
Alat-alat yang digunakan dalam percobaan adalah 5 buah erlenmeyer 100 mL, 2 buah pipet volume 10 mL, 2 buah pipet volume 25 mL, pipet tetes, 5 buah labu takar 100 mL, dan termometer 100 ºC.
3.3 Prosedur Kerja
3.3.1 Prosedur Kerja Asam Formiat
Diambil 5 mL larutan asam formiat 0,1 M lalu dimasukkan ke dalam tabu takar 50 mL. Ditambahkan air suling sampai batas tanda lalu dikocok sampai merata. Diambil 10 mL larutan dan dimasukkan ke dalam erlenmeyer, diukur suhu dan pH-nya, diulangi sampai dua kali. Masing-masing larutan yang diukur pH-nya ditetesi larutan petunjuk yang sesuai pengukuran. Dilakukan pengenceran bertingkat sebanyak 5 kali dan diberikan perlakuan yang sama dengan larutan pertama.
3.3.2 Prosedur Kerja Asam Asetat
Diambil 5 mL larutan asam asetat 0,1 M lalu dimasukkan ke dalam tabu takar 50 mL. Ditambahkan air suling sampai batas tanda lalu dikocok sampai merata. Diambil 10 mL larutan dan dimasukkan ke dalam erlenmeyer, diukur suhu dan pH-nya, diulangi sampai dua kali. Masing-masing larutan yang diukur pH-nya ditetesi larutan petunjuk yang sesuai pengukuran. Dilakukan pengenceran bertingkat sebanyak 5 kali dan diberikan perlakuan yang sama dengan larutan pertama.
BAB IVHASIL DAN PEMBAHASAN
4.1 Hasil PengamatanTabel 1. Hasil pengamatan pH larutan asam formiat (HCOOH)
Tabel 2. Hasil pengamatan pH asam asetat (CH3COOH)
Konsentrasi (M) | pH | Suhu (ºC) | Indikator | Warna |
10-1 | 2 | 26 | Methyl violet | Ungu kehitaman |
10-2 | 3 | 28,5 | Methyl orange | Jingga kemerahan |
10-3 | 5 | 27 | Bromocresol | Hijau tua |
10-4 | 6 | 28 | Bromocresol green | Biru tua |
10-5 | 7 | 28 | Methyl red | Kuning |
|
Konsentrasi (M) |
pH |
Suhu (ºC) |
Indikator |
Warna |
|
10-1 |
3 |
25 |
Methyl orange |
Merah bata |
|
10-2 |
4 |
26 |
Methyl orange |
Jingga |
|
10-3 |
5 |
27 |
Bromocresol green |
Hijau tua |
|
10-4 |
6 |
27 |
Bromocresol green |
Biru tua |
|
10-5 |
7 |
27 |
Methyl red |
Kuning |
4.2 Perhitungan
4.2.1 Asam Formiat (HCOOH)
A. Pengenceran
1. Konsentrasi 0,1 M menuju 0,01 M
4.2.1 Asam Formiat (HCOOH)
A. Pengenceran
1. Konsentrasi 0,1 M menuju 0,01 M
V1M1 = V2M2
5 . 0,1 = 50 . M2
M2 = 0,01 M = 10-2 M
M2 = 0,01 M = 10-2 M
2. Konsentrasi 0,01 M menuju 0,001 M
V1M1 = V2M2
5 . 0,01 = 50 . M2
M2 = 0,001 M = 10-3 M
5 . 0,01 = 50 . M2
M2 = 0,001 M = 10-3 M
3. Konsentrasi 0,001 M menuju 0,0001 M
V1M1 = V2M2
5 . 0,001 = 50 . M2
M2 = 0,0001 M = 10-4 M
V1M1 = V2M2
5 . 0,001 = 50 . M2
M2 = 0,0001 M = 10-4 M
4. Konsentrasi 0,0001 M menuju 0,00001 M
V1M1 = V2M2
5 . 0,0001 = 50 . M2
M2 = 0,00001 M = 10-5 M
V1M1 = V2M2
5 . 0,0001 = 50 . M2
M2 = 0,00001 M = 10-5 M
5. Konsentrasi 0,00001 M menuju 0,000001 M
V1M1 = V2M2
5 . 0,00001 = 50 . M2
M2 = 0,000001 M = 10-6 M
V1M1 = V2M2
5 . 0,00001 = 50 . M2
M2 = 0,000001 M = 10-6 M
B. Tetapan Kesetimbangan Asam Lemah (Ka)
C. Penentuan Derajat Ionisasi
4.2.1 Asam Cuka (CH3COOH)
A. Pengenceran
1. Konsentrasi 0,1 M menuju 0,01 M
V1M1 = V2M2
5 . 0,1 = 50 . M2
M2 = 0,01 M = 10-2 M
2. Konsentrasi 0,01 M menuju 0,001 M
V1M1 = V2M2
5 . 0,01 = 50 . M2
M2 = 0,001 M = 10-3 M
3. Konsentrasi 0,001 M menuju 0,0001 M
V1M1 = V2M2
5 . 0,001 = 50 . M2
M2 = 0,0001 M = 10-4 M
4. Konsentrasi 0,0001 M menuju 0,00001 M
V1M1 = V2M2
5 . 0,0001 = 50 . M2
M2 = 0,00001 M = 10-5 M
5. Konsentrasi 0,00001 M menuju 0,000001 M
V1M1 = V2M2
5 . 0,00001 = 50 . M2
M2 = 0,000001 M = 10-6 M
B. Tetapan Kesetimbangan Asam Lemah (Ka)
C. Penentuan Derajat Ionisasi
4.3 Pembahasan
Pengenceran dilakukan dengan mencampur larutan pekat dengan pelarut agar diperoleh volume akhir yang lebih besar. Pada percobaan asam formiat dan asam asetat diencerkan sehingga dihasilkan larutan yang mempunyai konsentrasi lebih rendah dari sebelumnya. Berdasarkan hasil percobaan, semakin kecil konsentrasi larutan maka semakin besar pula nilai Ka. Sedangkan pada hasil perhitungan derajat ionisasi, tampak bahwa semakin kecil konsentrasi larutan, maka akan semakin besar derajat ionisasinya. Dengan demikian, data yang diperoleh dari hasil percobaan telah berhasil membuktikan hukum Le Châtelier bahwa jika tekanan eksternal diterapkan pada sistem kesetimbangan, maka sistem akan menyesuaikan sedemikian rupa sehingga sebagian tegangan diimbangi karena mencoba untuk membangun kembali keadaan setimbang. Tekanan eksternal yang diberikan pada larutan adalah berupa perubahan konsentrasi sehingga tetapan kesetimbangan pun semakin kecil sedangkan derajat ionisasi semakin besar.
Dari hasil percobaan yang diperoleh, nilai rata-rata Ka dari larutan asam formiat adalah 2,2.10-3 sedangkan rata rata derajat ionisasinya adalah 46%. Adapun diperoleh nilai Ka rata-rata dari larutan asam asetat adalah 2,22.10-3 sedangkan rata rata derajat ionisasinya adalah 10%.
BAB VKESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan dari percobaan yang telah dilakukan adalah sebagai berikut:
- Semakin rendah konsentrasi suatu larutan asam lemah, maka nilai pH akan semakin tinggi.
- Semakin banyak pengenceran yang dilakukan, maka semakin rendah harga konsentrasi suatu larutan asam lemah, sehingga semakin tinggi pula nilai pH larutan.
- Derajat ionisasi suatu larutan dapat diketahui berdasarkan nilai pH suatu larutan.
5.2 Saran
Dalam melakukan praktikum, sebaiknya dilakukan dengan lebih teliti agar tidak terjadi penyimpangan pada hasil praktikum.
DAFTAR PUSTAKA
Brown, Theodore L.,
Eugene L., Bruce E. B., Catherine J.M. dan Patrick M.W., 2012, Chemistry the Central Science 12th
Edition, Amerika Serikat, Pearson Prentice Hall.
Chang, R., 2008, Chemistry, Tenth Edition. New York,
McGraw-Hill Higher Education.
Chang, R., 2010,
General Chemistry: The Essential
Concepts, Fifth Edition. New York, McGraw-Hill Higher Education.
Goldberg, D.E., 2004,
Kimia untuk Pemula, Schaum’s Easy
Outlines, Jakarta, Erlangga.
Muti’ah, 2015, Analisis
Miskonsepsi Mahasiswa pada Empat Konsep Esensial Kesetimbangan Kimia, Mataram, Jurnal
Pijar MIPA, 7(1): 27-32.
Petrucci, R.H., 2011,
Kimia Dasar: Prinsip-Prinsip dan Aplikasi
Modern, Jakarta: Erlangga.
Tidak untuk disalin!
Artikel ini dibagikan untuk memberi contoh dan menginspirasi:)




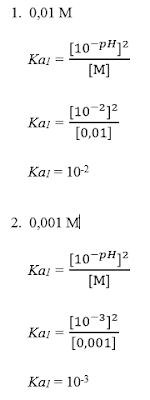






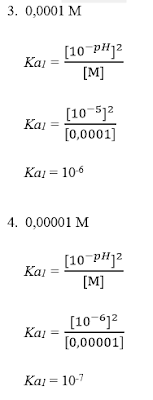















0 Comment:
Post a Comment